In Situ Serial Crystallography Workshop at the SLS
The Macromolecular Crystallography group at SLS is organizing a three days workshop on in situ serial crystallography (http://indico.psi.ch/event/issx) between November 17 and 19, 2015. It will be dedicated in the presentation of a novel method facilitating the structure determination of membrane proteins, which are highly important pharmaceutical targets but are difficult to handle using 'classical' crystallographic tools. Designed for 20 Ph.D. students, postdocs and young scientists from both academia and industry, the workshop will consist of introductory lectures, followed by hands-on practicals on in meso or lipidic cubic phase (LCP) crystallization, on in situ serial crystallography data collection using a micro-sized beam and on data processing.
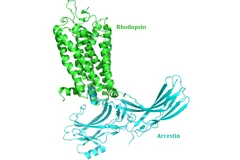
New insight into receptor signalling
A team of 72 investigators across 25 institutions including researchers from the Paul Scherrer Institut obtained the X-ray structure of a rhodopsinàarrestin complex, which represents a major milestone in the area of G-protein-coupled-receptor (GPCR), a protein family recognized in the award of the 2012 Nobel Prize in Chemistry.
Gemeinsam statt einsam
An SwissFEL und SLS Biomoleküle entschlüsseln: Proteine sind ein begehrtes, aber widerspenstiges Forschungsobjekt. Eine für Freie-Elektronen-Röntgenlaser wie dem zukünftigen SwissFEL des PSI entwickelte Methode soll ihre Erforschung nun ein grosses Stück vorantreiben. Dabei werden viele identische, kleine Proteinproben in kurzen Abständen hintereinander mit einem Röntgenstrahl durchleuchtet. Damit wird ein bisheriges Hauptproblem der Erforschung von Proteinen umgangen: Proben in ausreichender Grösse herzustellen.
Schneller zum Porträt des Proteins
Alle Lebewesen, vom Bakterium bis zum Menschen, sind für die Verrichtung ihrer vitalen Funktionen auf Proteine angewiesen. Wie die Proteine ihre Aufgaben erfüllen, hängt von ihrer Struktur ab. Forschende des Paul Scherrer Instituts haben nun eine neuartige Methode entwickelt, um die Kristallstruktur von Proteinen mithilfe von Röntgenlicht schneller herauszufinden. Dies könnte in Zukunft auch die Entwicklung neuer Medikamente beschleunigen. Die Studie wird am 15. Dezember im Fachmagazin Nature Methods veröffentlicht.
Wie der Körper Fremdes von Eigenem unterscheiden - wesentliche Struktur aufgeklärt
Ähnlich einem Schredder zerlegt das Immunoproteasom Eiweisse in kleine Bruchstücke, die dann an der Oberfläche der Zelle präsentiert werden. Werden diese Eiweissteile als körperfremd erkannt, vernichtet das Immunsystem die Zelle. Bei Autoimmunerkrankungen wie Rheuma ist dieser Prozess gestört. Helfen könnte da, das Immunoproteasom zu hemmen. Mit Hilfe von Messungen am Paul Scherrer Institut ist es nun erstmals gelungen, die Struktur des Immunoproteasoms aufzuklären und Angriffsstellen für neue Medikamente aufzuzeigen.
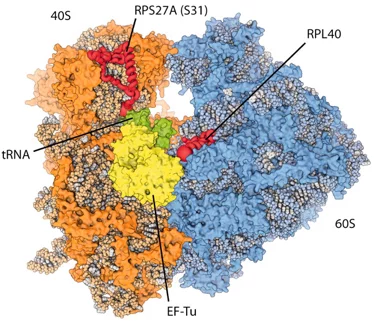
New insights into the cell’s protein factory
Eukaryotic ribosomes are among the most complex cellular machineries of the cell. These large macromolecular assemblies are responsible for the production of all proteins and are thus of pivotal importance to all forms of life. Two independent research groups at the ETH Zürich and the Institute of Genetics and Molecular and Cellular Biology in Strasbourg have obtained new insights into the atomic structure of the eukaryotic ribosome. The results have been published in the journal Science.
Dem Rätsel der Centriolen-Bildung auf der Spur
In menschlichen Zellen finden sich stammesgeschichtlich sehr alte Funktionseinheiten, die als Centriolen bezeichnet werden. Ein Forscherteam vom PSI und der ETH Lausanne hat nun erstmals ein Modell für die Bildung der Centriolen vorgestellt. Das erstaunende Ergebnis ist, dass die Neuner-Symmetrie des Centriols durch die Fähigkeit eines einzelnen Proteins sich selbst zu organisieren zustande kommt.