In Situ Serial Crystallography Workshop at the SLS
The Macromolecular Crystallography group at SLS is organizing a three days workshop on in situ serial crystallography (http://indico.psi.ch/event/issx) between November 17 and 19, 2015. It will be dedicated in the presentation of a novel method facilitating the structure determination of membrane proteins, which are highly important pharmaceutical targets but are difficult to handle using 'classical' crystallographic tools. Designed for 20 Ph.D. students, postdocs and young scientists from both academia and industry, the workshop will consist of introductory lectures, followed by hands-on practicals on in meso or lipidic cubic phase (LCP) crystallization, on in situ serial crystallography data collection using a micro-sized beam and on data processing.
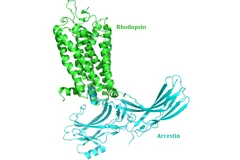
New insight into receptor signalling
A team of 72 investigators across 25 institutions including researchers from the Paul Scherrer Institut obtained the X-ray structure of a rhodopsinàarrestin complex, which represents a major milestone in the area of G-protein-coupled-receptor (GPCR), a protein family recognized in the award of the 2012 Nobel Prize in Chemistry.
L’union fait la force
Décrypter les molécules au SwissFEL et à la SLSLes protéines sont un objet de recherche convoité, mais récalcitrant. Leur étude est aujourd’hui facilitée par une nouvelle méthode développée à l’aide d’un laser à rayons X à électrons libres comme le futur SwissFEL du PSI. Elle consiste à exposer à intervalles rapprochés de petits échantillons identiques de protéines à de la lumière de type rayons X. On contourne ainsi un problème majeur auquel la recherche sur les protéines s’est heurtée jusqu’ici: produire des échantillons de taille suffisante.
Obtenir plus rapidement le portrait d’une protéine
Tous les êtres vivants, de la bactérie à l’être humain, ont besoin de protéines pour l’accomplissement de leurs fonctions vitales. La manière dont les protéines remplissent leurs tâches dépend de leur structure. Des chercheurs de l’Institut Paul Scherrer (PSI) ont développé une méthode novatrice, qui permet de déterminer plus rapidement la structure cristalline des protéines, grâce à de la lumière de type rayons X. Elle pourrait ainsi accélérer le développement de nouveaux médicaments. Leur étude sera publiée le 15 décembre dans la revue spécialisée « Nature Methods ».
Wie der Körper Fremdes von Eigenem unterscheiden - wesentliche Struktur aufgeklärt
Ähnlich einem Schredder zerlegt das Immunoproteasom Eiweisse in kleine Bruchstücke, die dann an der Oberfläche der Zelle präsentiert werden. Werden diese Eiweissteile als körperfremd erkannt, vernichtet das Immunsystem die Zelle. Bei Autoimmunerkrankungen wie Rheuma ist dieser Prozess gestört. Helfen könnte da, das Immunoproteasom zu hemmen. Mit Hilfe von Messungen am Paul Scherrer Institut ist es nun erstmals gelungen, die Struktur des Immunoproteasoms aufzuklären und Angriffsstellen für neue Medikamente aufzuzeigen.Cette actualité n'existe qu'en anglais et allemand.
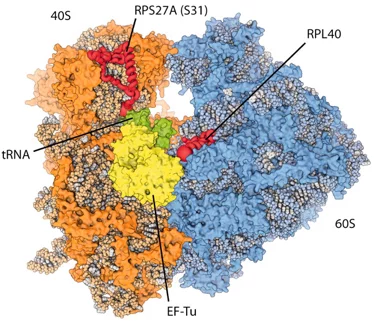
New insights into the cell’s protein factory
Eukaryotic ribosomes are among the most complex cellular machineries of the cell. These large macromolecular assemblies are responsible for the production of all proteins and are thus of pivotal importance to all forms of life. Two independent research groups at the ETH Zürich and the Institute of Genetics and Molecular and Cellular Biology in Strasbourg have obtained new insights into the atomic structure of the eukaryotic ribosome. The results have been published in the journal Science.
Sur la piste du mystère de la formation des centrioles
Les cellules humaines contiennent des unités fonctionnelles appelées centrioles qui jouent un rôle important dans la division cellulaire. Une équipe de chercheurs de l’institut Paul Scherrer PSI et de l’EPF Lausanne, a pour la première fois établi un modèle moléculaire pour la formation des centrioles. Le découverte surprend: La symétrie d’ordre neuf découlait de la capacité d’une seule protéine à s’organiser elle-même.