Grundlage für die Entwicklung neuer Medikamente gegen Autoimmunerkrankungen
Ähnlich einem Schredder zerlegt das Immunoproteasom Eiweisse in kleine Bruchstücke, die dann an der Oberfläche der Zelle präsentiert werden. Werden diese Eiweissteile als „körperfremd“ erkannt, vernichtet das Immunsystem die Zelle. Bei Autoimmunerkrankungen wie Rheuma ist dieser Prozess gestört. Helfen könnte da, das Immunoproteasom zu hemmen. Biochemikern der Technischen Universität München (TUM) und der Universität Konstanz gelang es nun mit Hilfe von Messungen am Paul Scherrer Institut erstmals, die Struktur des Immunoproteasoms aufzuklären und Angriffsstellen für neue Medikamente aufzuzeigen. Ihre Ergebnisse präsentieren sie in der renommierten Fachzeitschrift Cell.
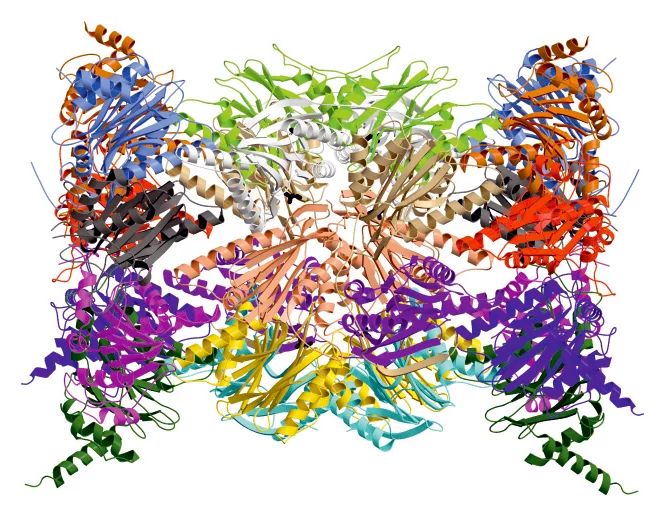
Das Proteasom, ein grosser, zylinderförmiger Eiweisskomplex, spielt in den Zellen des Körpers eine lebenswichtige Rolle. Ähnlich einer Recyclinganlage zerlegt es nicht mehr benötigte Proteine in kleinere Stücke, so dass diese wiederverwertet werden können. Auf diese Weise steuert das Proteasom essentielle Funktionen der Zelle: Es reguliert Zellwachstum sowie Zellteilung und baut überflüssige oder defekte Proteine ab.
Ähnlich und doch verschieden: Gestörtes Gleichgewicht zwischen Molekülen führt zu Krankheiten
Eine spezialisierte Form des Proteasoms, die es nur in höheren Lebewesen wie Säugern gibt, ist das Immunoproteasom. Es unterscheidet sich in einigen Details vom normalen, so genannten konstitutiven
Proteasom. Als wichtiger Partner des Immunsystems schneidet das Immunoproteasom die Proteine so, dass die Eiweissbruchstücke als sogenannte Antigene
an die Zelloberfläche präsentiert werden können. Handelt es sich dabei um ein Fragment eines körperfremden Eiweisses – etwa von einem zuvor eingedrungenen Virus, wird die infizierte Zelle vom Immunsystem vernichtet.
Bei manchen Krebsarten sowie bei Autoimmunerkrankungen wie Rheuma, Diabetes Typ I und Multipler Sklerose ist das Gleichgewicht zwischen den beiden Proteasomarten zu Gunsten des Immunoproteasoms verschoben. Blockiert man das Immunoproteasom, kann das korrekte Gleichgewicht wieder hergestellt und die Krankheit behandelt werden. Deshalb suchen Wissenschaftler mit grossem Einsatz nach alternativen Wirkstoffen, die spezifisch nur das Immunoproteasom angreifen. Da jedoch dessen atomare Struktur bislang nicht bekannt war, gestaltete sich die Suche sehr schwierig.
Struktur geklärt – Ein Baustein macht den Unterschied
Nun gelang Wissenschaftlern um Professor Michael Groll, Inhaber des Lehrstuhls für Biochemie am Department Chemie der TU München und seiner Mitarbeiterin Eva Maria Huber in Zusammenarbeit mit Professor Marcus Groettrup, Inhaber des Lehrstuhls für Immunologie der Uni Konstanz und Leiter des Biotechnologie Instituts Thurgau (BITg) in Kreuzlingen, ein wesentlicher Durchbruch: Mit Hilfe der Röntgenstrukturanalyse am Paul Scherrer Institut bestimmten sie erstmals den exakten atomaren Aufbau sowohl des Immunoproteasoms als auch des konstitutiven Proteasoms der Maus.
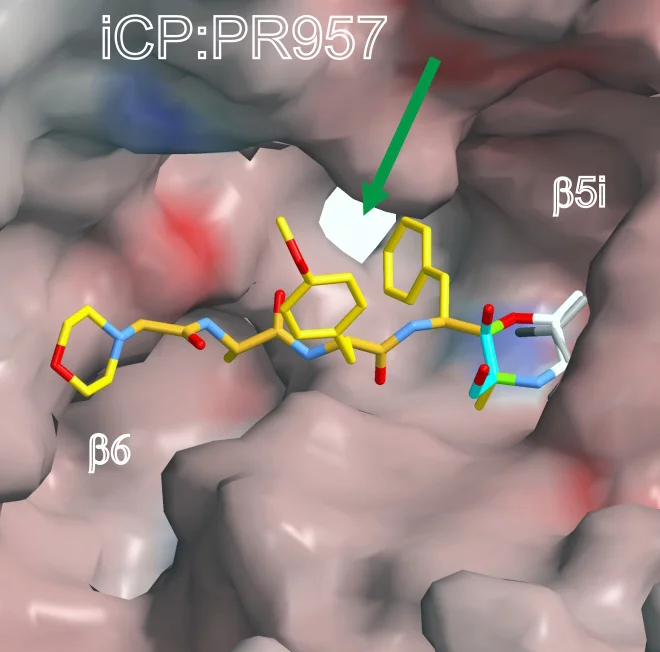
Beide Strukturen bestimmten die Wissenschaftler jeweils ohne und mit einem gebundenen Hemmstoff, dem Wirkstoff PR-957 (ONX 0914). PR-957 ist ein vielversprechender Proteasomhemmer, der spezifisch nur das Immuno- und nicht das konstitutive Proteasom hemmt. Warum der Wirkstoff dies jedoch tut war nicht bekannt – bis jetzt. Wir konnten nun zum ersten Mal auf atomarer Ebene beobachten, wie und wo der Hemmstoff an beiden Proteasomtypen angreift und so erklären warum er nur das Immunoproteasom blockiert
, erklärt Groll. Auf dieser Basis können wir nun neue, spezifischere Hemmstoffe entwickeln – das ist ein grosser Fortschritt.
An Hand der Kristallstruktur des Immunoproteasoms konnten die Forscher um Groll und Huber die molekulare Ursache identifizieren, die dafür sorgt, dass PR-957 nur den einen der beiden Proteasomtypen hemmt. Es handelt sich dabei um einen einzigen Proteinbausstein, die Aminosäure Methionin, die sich in einer „Tasche“ des Proteasoms befindet, die für das exakte Zerschneiden der Eiweisse verantwortlich ist. Beide Proteasomtypen besitzen hier eine fast identische Anordung der Aminosäuren. Kleine Unterschiede in der Umgebung des Methionins sorgen jedoch dafür, dass diese Aminosäure im Immunoproteasom anders gedreht ist als im normalen Proteasom. Dieser geringe Unterschied macht sehr viel aus
, erklärt Eva Maria Huber. Er vergrössert die Tasche am Immunoproteasom, sodass grosse Aminosäurereste hinein passen und der Hemmstoff binden kann. Beim konstitutiven Proteasom ist die Tasche kleiner, und der Wirkstoff passt nicht hinein.
Hoffnung auf neue Medikamente
Der feine Unterschied zwischen beiden Proteasomtypen ist ein wichtiger Schritt zur Entwicklung neuer Medikamente gegen Autoimmunerkrankungen. Bei diesen Krankheiten ist das Immunoproteasom zu aktiv, sodass das Immunsystem fälschlicherweise eigenes Gewebe angreift. Mit Hilfe der neuen Erkenntnisse zur genauen Struktur des Immunoproteasoms können Wissenschaftler nun neue Wirkstoffe entwickeln, die das Immunoproteasom gezielt hemmen, ohne das konstitutive Proteasom, das die korrekte Funktion aller Zellen aufrecht erhält, dabei zu stark mit zu beeinflussen.
Synchrotronlicht zeigt Strukturen im Detail
Die Molekülstrukturen für diese Arbeit sind an der Synchrotron Lichtquelle Schweiz SLS des Paul Scherrer Instituts bestimmt worden. In dem verwendeten Verfahren werden die Moleküle, die untersucht werden sollen, in einer regelmässigen Kristallstruktur angeordnet und anschliessend mit Synchrotronlicht aus der SLS durchleuchtet. Aus der Art, wie das Licht dabei abgelenkt wird, können die Forschenden auf den genauen Aufbau des Moleküls schliessen. Das PSI bietet an der SLS drei Messplätze für dieses Verfahren an. Forschende aus Wissenschaft und Industrie, aus dem In- und Ausland stehen in einem heftigen Wettbewerb um Zugang und damit Messzeit an diesen Experimentierplätzen zu erhalten.
Die Arbeiten wurden mit Mitteln der Deutschen Forschungsgemeinschaft (SFB595/TP A11), des Bundesministeriums für Bildung und Forschung (ProNet-T3/TP To-03), des Schweizer Nationalfonds (31003A_138451) sowie des Exzellenzclusters Center for Integrated Protein Science Munich (CIPSM) unterstützt. Die Messungen wurden an der PXI- und PXIII-Beamline des Paul Scherrer Instituts (Villigen, Schweiz) durchgeführt.
Text auf Grundlage einer Pressemitteilung der Technischen Universität München
Über das PSI
Das Paul Scherrer Institut entwickelt, baut und betreibt grosse und komplexe Forschungsanlagen und stellt sie der nationalen und internationalen Forschungsgemeinde zur Verfügung. Eigene Forschungsschwerpunkte sind Materie und Material, Elementarteilchenphysik, Biologie und Medizin, Energie- und Umweltforschung. Mit 1400 Mitarbeitenden und einem Jahresbudget von rund 300 Mio. CHF ist es das grösste Forschungsinstitut der Schweiz.
Kontakt / Ansprechpartner
Prof. Dr. Michael Groll, Technische Universität München, Lehrstuhl für Biochemie
Lichtenbergstr. 4, 85748 Garching, Deutschland
Tel: +49 (0)89 289 13361; E-Mail: michael.groll@ch.tum.de
Internet: http://www.biochemie.ch.tum.de/
Prof. Dr. Marcus Groettrup; Universität Konstanz; Professor für Immunologie
Universitätsstraße 10; 78464 Konstanz; Deutschland; Telefon: +49 (0)7531 / 88-2254
E-Mail: Marcus.Groettrup@uni-konstanz.de
Dr. Michael Basler, Biotechnologie Institut Thurgau (BITg), Unterseestrasse 47,
8280 Kreuzlingen, Schweiz; Telefon: +41 (0)71 678 5020
E-Mail: Michael.Basler@uni-konstanz.de; http://www.bitg.ch
Dr. Takashi Tomizaki, Labor Makromoleküle und Bioimaging, Paul Scherrer Institut, Villigen PSI, Schweiz,
Telefon: +41 56 310 51 29, E-Mail: takashi.tomizaki@psi.ch
Originalveröffentlichung
Immuno- and constitutive proteasome crystal structures reveal differences in substrate and inhibitor specificity, Eva M. Huber, Michael Basler, Ricarda Schwab, Wolfgang Heinemeyer, Christopher J. Kirk, Marcus Groettrup, Michael Groll, Cell, 17. Februar 2012
Weiterführende Informationen:
Forschen mit Synchrotronlicht
Die beiden bei dieser Arbeit genutzten Messplätze:
http://www.psi.ch/sls/pxi/pxi
http://www.psi.ch/sls/pxiii/pxiii