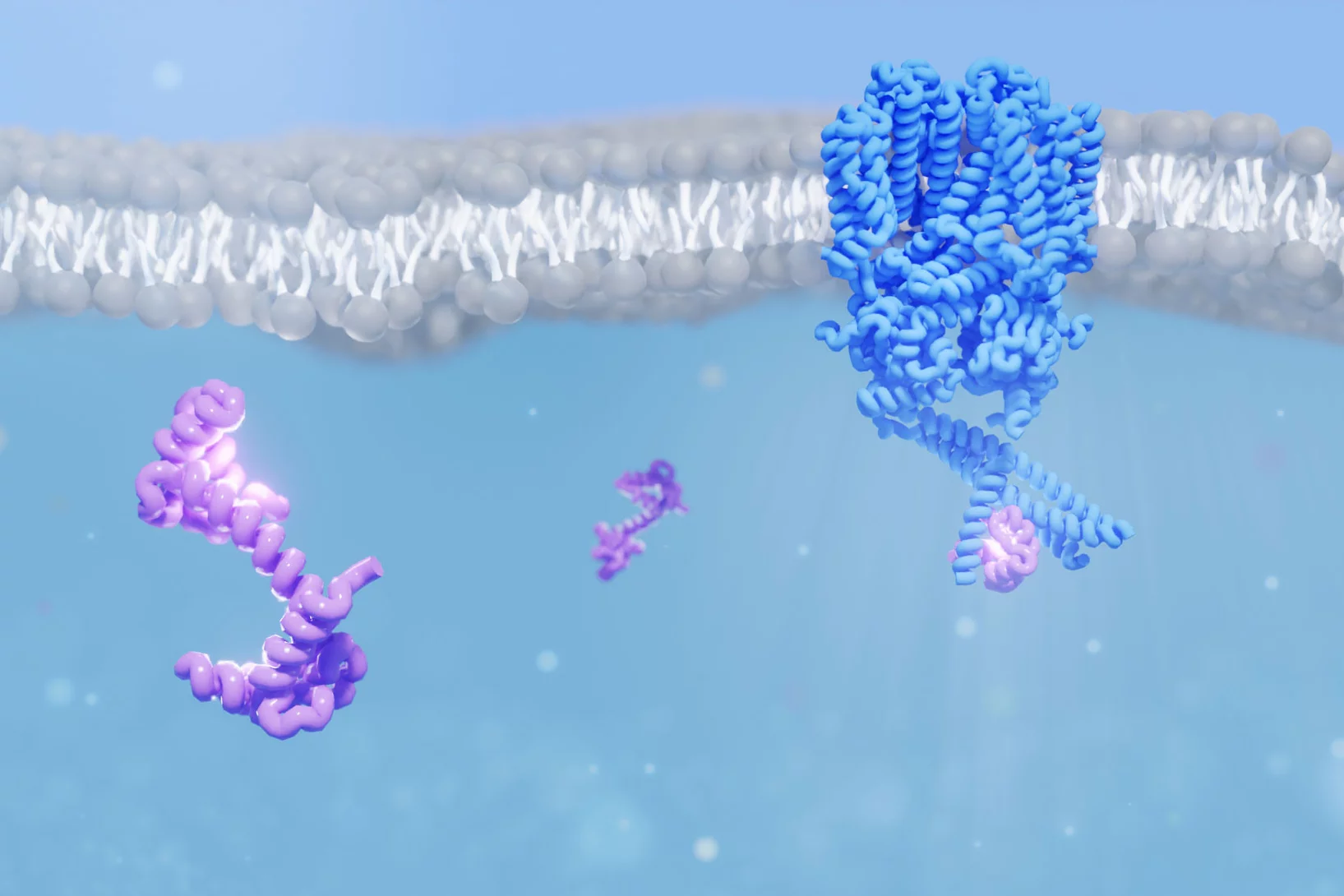
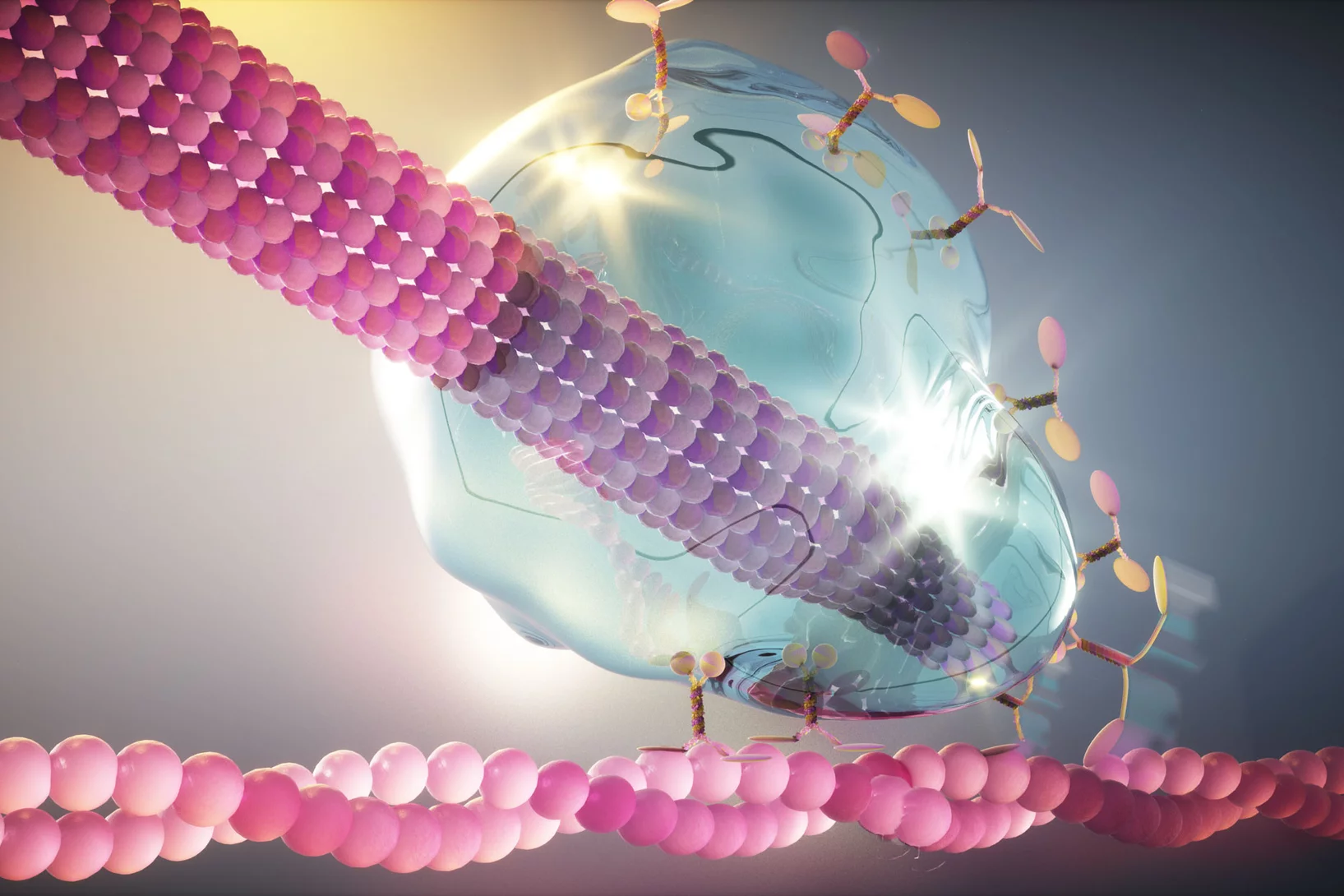
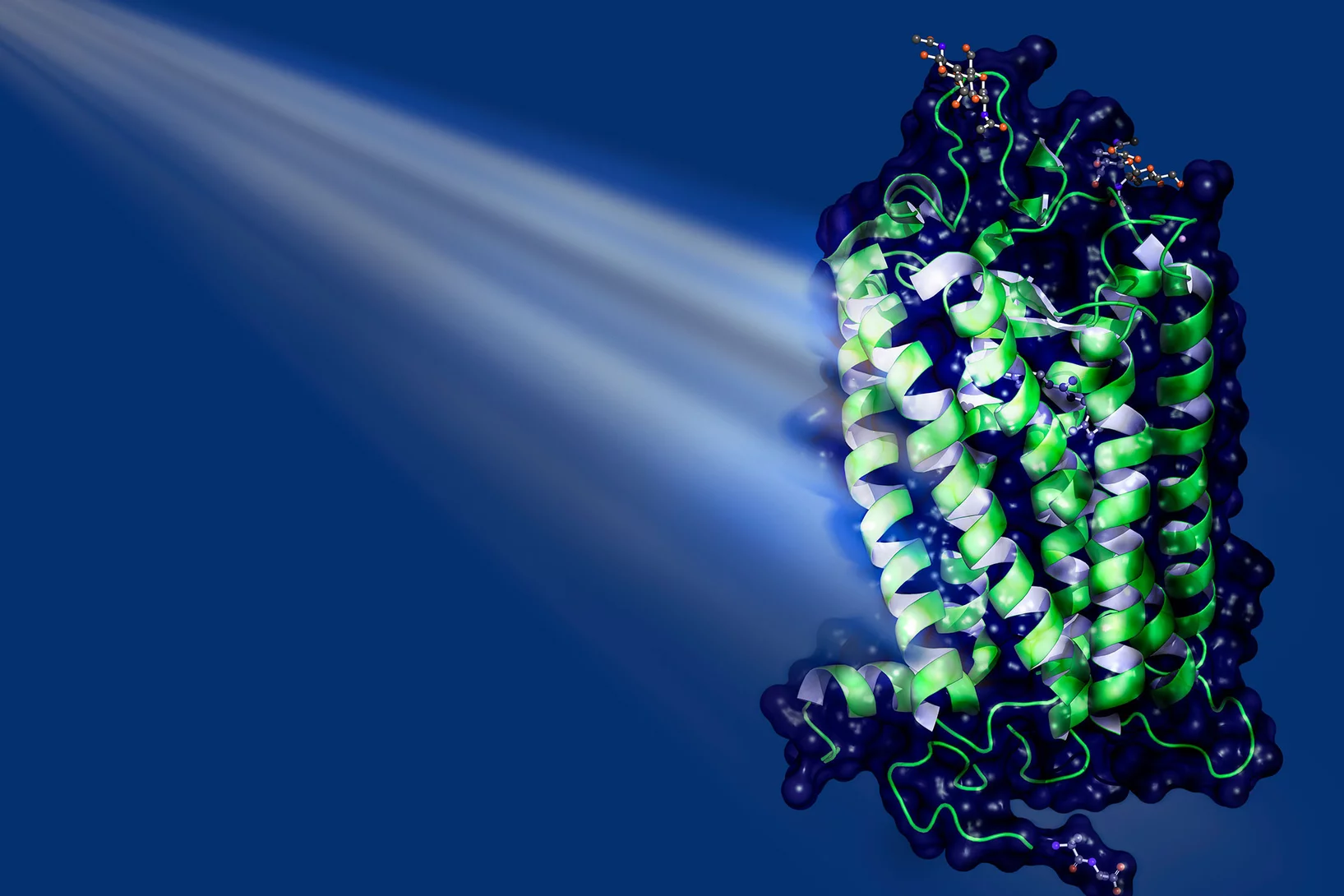
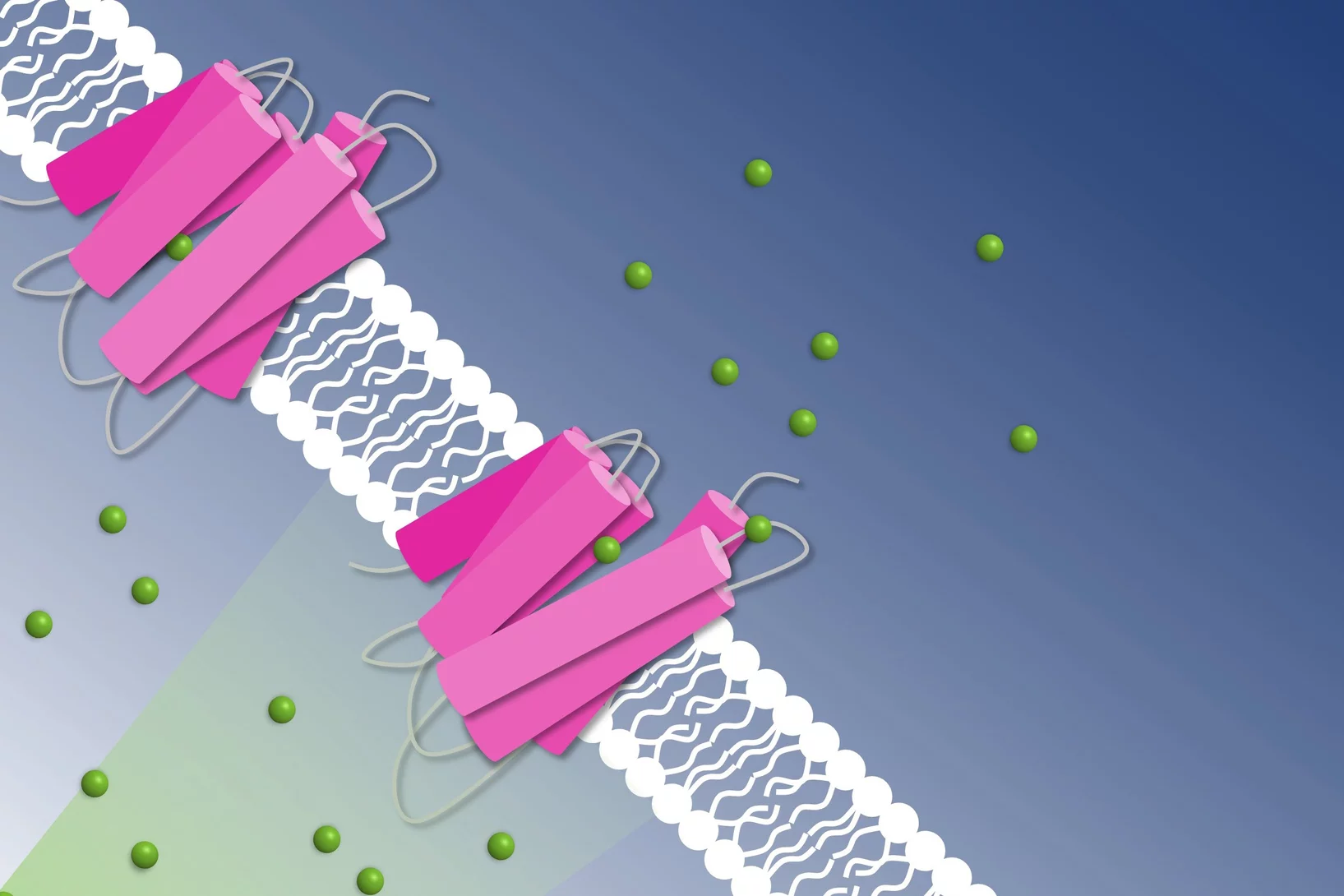
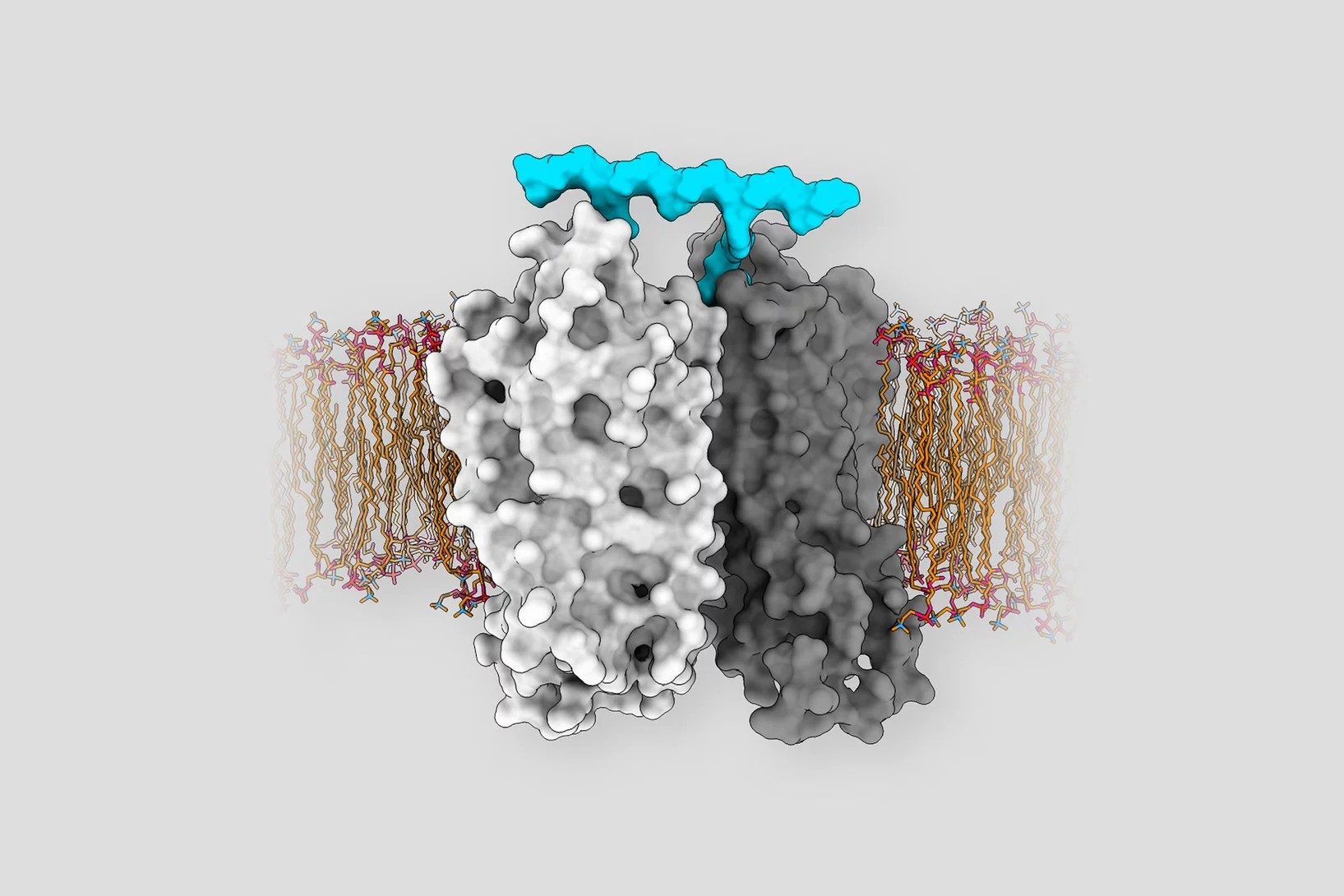
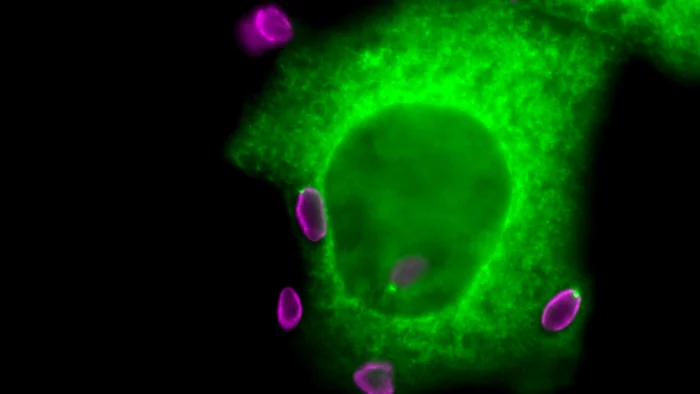
Comment le Botox pénètre dans nos cellules
Des scientifiques du PSI ont identifié des modifications structurelles moléculaires de la neurotoxine bactérienne Botox qui sont importantes pour son absorption par les cellules nerveuses. Cela pourrait permettre à l'avenir des utilisations plus ciblées du Botox en médecine.
Vers une médecine contrôlée par la lumière
Des scientifiques du PSI ont élucidé la structures de certains photorécepteurs spéciaux.
Déchiffrer l’énigme des protéines
Cette année, le prix Nobel de chimie est attribué à trois chercheurs qui ont contribué de manière déterminante à déchiffrer le code des protéines, ces importants éléments constitutifs de la vie. Mais pour que des applications puissent être développées à partir de ces connaissances, par exemple dans le domaine médical, des centres de recherche comme le PSI sont indispensables.
Slipping a note to a neighbour: the cellular way
Study reveals how drug molecules bind in channels between neighbouring cells, changing intercellular communication.
Une bionanomachine pour la chimie verte
Des scientifiques du PSI ont caractérisé une enzyme bactérienne unique en son genre, qui permet une importante réaction chimique.
Recherche au PSI en 2023: des signes prometteurs
La revue des douze derniers mois.
De nouvelles possibilités pour une toxine aux propriétés salutaires
Des scientifiques du PSI découvrent un surprenant mécanisme qui pourrait élargir le spectre d’utilisation du Botox comme substance thérapeutique.
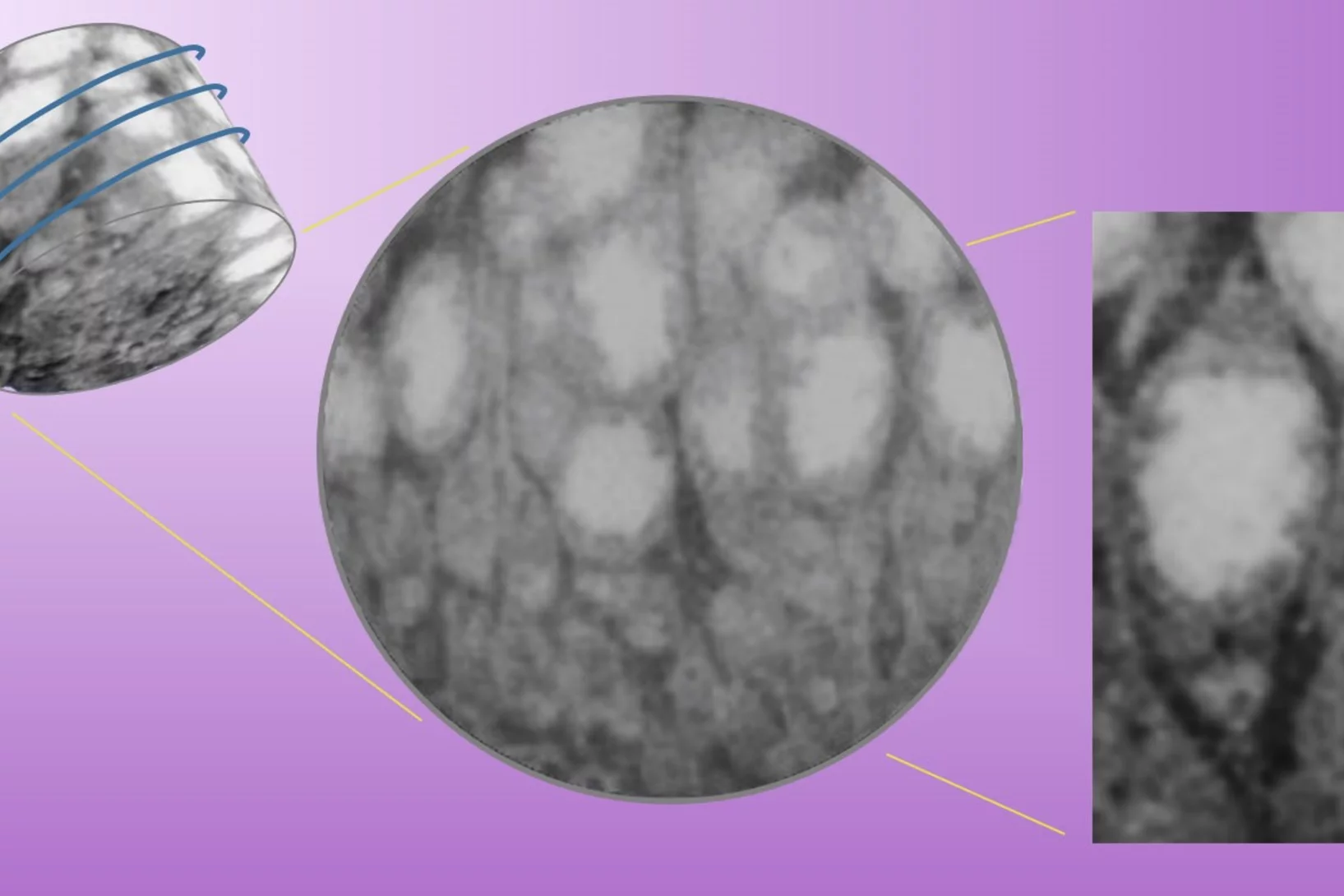
Bien plus qu’une simple structure de soutien
Chacune des cellules de notre corps abrite un cytosquelette. Contrairement à son nom, ce réseau est bien plus qu’une pure structure de soutien.
Plongée dans le cytosquelette
Le cytosquelette est un petit prodige. Son exploration promet, entre autres, de nouvelles possibilités de traitement contre le cancer.
Sandra Mous received the ETH Medal for her dissertation at ETH Zurich
Sandra Mous received the ETH Medal for her dissertation at ETH Zurich under the supervision of Prof. Gebhard F.X. Schertler, Division Head of Biology and Chemistry at PSI. She captured the first molecular movie of an anion transported across the cell membrane by a protein pump. Congratulations!
Un algorithme pour des films de protéines plus nets
Un algorithme qui vient d’être développé permet d’analyser plus efficacement les mesures faites aux lasers à rayons X à électrons libres.
Calcium sensor helps us to see the stars
New insight into how the protein calmodulin interacts with an ion channel in the eye could explain how our eyes achieve remarkable sensitivity to dim light.
Ainsi débute la vision
Des chercheurs du PSI ont analysé ce qui se passait tout au début dans l’œil quand la lumière atteint la rétine.
Utiliser la lumière pour activer et désactiver des médicaments
Des chercheurs du PSI tournent un film moléculaire d’un médicament anticancer doté d’un interrupteur. Cela ouvre de nouvelles perspectives pour les développeurs de substances actives.
The clever glue keeping the cell’s moving parts connected
Optimised by nature over 100 million years of evolution, this smart liquid provides a crucial coupling that ensures cell division correctly proceeds.
A new spin on sample delivery for membrane proteins
Proteins hover in front of the X-ray beam at a Swiss Light Source beamline. Now, spinning thin films bring on board these trickiest of proteins.
Trouver des principes actifs contre le cancer
Des chercheurs du PSI ont développé une nouvelle substance qui inhibe une protéine vitale du cytosquelette.
Une nouvelle venue en biologie structurale
Avec l’aide de la cryomicroscopie, de nombreuses énigmes liées aux protéines photosensibles peuvent être résolues de manière rapide et très précise.
L’univers miraculeux des antennes moléculaires
Comment des processus dans des cellules peuvent être activer et désactiver par des récepteurs de lumière
How to get chloride ions into the cell
A molecular movie shot at PSI reveals the mechanism of a light-driven chloride pump
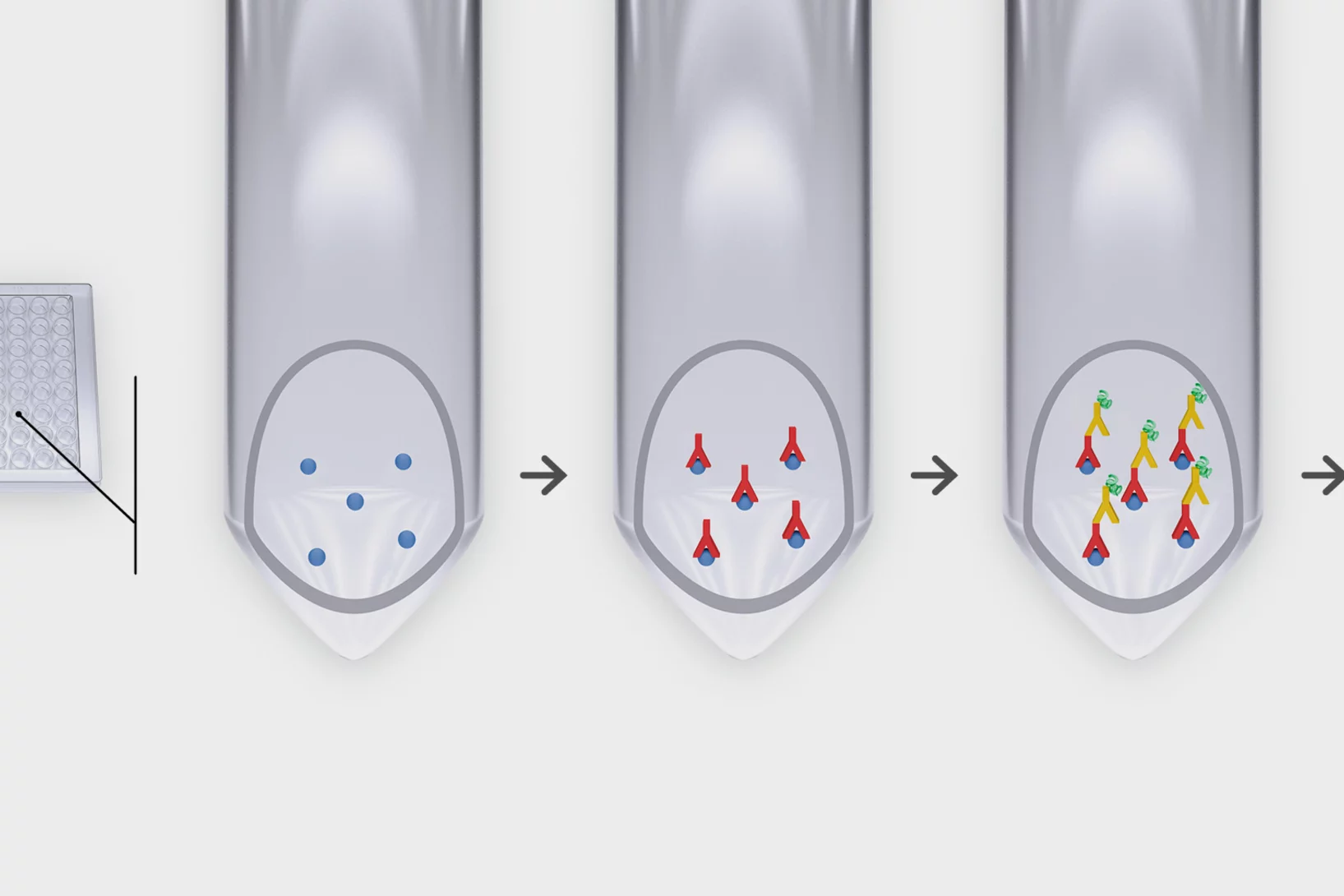
Covid-19: un nouveau test rapide plus performant
Le test identifie les différents variants du virus et améliore le pronostic de la maladie.
Mieux comprendre le sens de la vue
Des chercheurs du PSI ont mis en lumière la structure d’un élément important dans l’œil: le canal ionique CNG qui permet au signal visuel d’être transmis au cerveau.
Biased signalling for better drugs
A dream drug would provide a targeted therapeutic effect without side effects. Biased signalling could make this a reality. Publishing in PNAS, PSI researchers present a platform for biased signalling-based drug discovery.
Neurodegenerative disease studied by cryogenic X-ray nanotomography
Hard X-ray cryo-tomography scanning of retina from healthy and inherited blindness specimen paves the way for correlative analysis after imaging at the cSAXS beamline.
Nouvel antiparasite
Des chercheurs du PSI identifient un principe actif potentiel contre plusieurs parasites unicellulaires, dont ceux à l’origine du paludisme et de la toxoplasmose.
Coronavirus: dissiper le flou qui entoure les chiffres
L'hôpital universitaire de Zurich utilise des protéines produites par le PSI pour une étude afin de déterminer combien de personnes ont été infectées par le coronavirus.
Preventing the break-in of the toxoplasmosis parasite
Scientists have identified the structure and functions of RON13, an enzyme of the toxoplasmosis parasite that is essential for the infectious mechanism in humans.
PSI: constants progrès dans la lutte contre le coronavirus
Analyses de structures cristallines, modèles informatiques, cultures cellulaires: dans ses recherches sur Sars-CoV-2, le PSI emprunte de nombreuses voies. Aperçu.
Comment fonctionne l’activation des cellules immunitaires
Le récepteur CCR5 aide à guider les cellules du système immunitaire vers les foyers d’infection. Un consortium de chercheurs a déchiffré son processus d’activation.
Le cytosquelette, cible de nouveaux médicaments
En combinant simulations informatiques et expériences de laboratoire, des chercheurs du PSI ont identifié pour des médicaments de nouveaux domaines de liaison potentiels sur la tubuline, une protéine vitale.