Chacune des cellules de notre corps abrite un réseau de fins filaments appelé «cytosquelette». Contrairement à son nom, ce réseau est bien plus qu’une pure structure de soutien. Il remplit nombre de fonctions vitales. Il représente donc un domaine de recherche prometteur en biologie comme en médecine, qui offre de multiples pistes pour des thérapies novatrices.
Tous les êtres vivants sont composés d’au moins une cellule, unité fondamentale de la vie. La plupart des plantes et des animaux sont constitués d’une multitude de cellules – et l’être humain d’environ trente milliards. En elle-même, toute cellule est déjà une entité d’une énorme complexité. Pour mieux faire comprendre son mode de fonctionnement, les enseignants recourent souvent à une analogie: le modèle idéal de la cité-Etat. Le noyau cellulaire, où se trouve une grande partie du matériel génétique – c’est-à-dire les plans des composants essentiels de la cellule –, forme le quartier gouvernemental. C’est là que l’on détermine les règles de fonctionnement de l’entité dans son ensemble. Les ribosomes sont les fabriques qui bâtissent tout ce dont la ville a besoin, entre autres plusieurs milliers de protéines différentes, suivant les plans de construction conservés dans la centrale (les gènes). Ces mêmes protéines ainsi que les nutriments de l’extérieur, les messagers et d’autres substances sont transportés d’un endroit à l’autre dans des vésicules, comme les colis par la poste. Les transporteurs sont ce qu’on appelle des «protéines motrices»: elles acheminent les colis jusqu’à leur destination, c’est-à-dire les différents établissements de la cité.
A côté du quartier gouvernemental, sis dans le noyau cellulaire, on trouve notamment les mitochondries. Comme des centrales, elles produisent de l’adénosine-triphosphate (ATP) à partir des nutriments ingérés, autrement dit l’énergie qui assure le bon fonctionnement de la cité. Il existe une maison de vente par correspondance, appelée «appareil de Golgi», où les marchandises de la fabrique sont préparées pour leur transport. Il y a enfin des postes-frontières (endosomes) aux remparts (membrane cellulaire) et aux portes (canaux membranaires) de la cité, qui contrôlent l’accès des marchandises venues de l’extérieur. La police (peroxysomes) arrête les intrus et les évacue, souvent en collaboration avec le service de voirie (lysosomes) qui élimine les résidus.
Le transport de marchandises, évoqué plus haut, et l’échange d’informations sont essentiels au bon fonctionnement de la cellule. Les deux se déroulent dans les rues de la ville, qui relient tout au sein d’un vaste réseau ramifié. Celui-ci correspond, dans la cellule, à ce qu’on appelle le «cytosquelette». Il est notamment responsable du transport des composants cellulaires le long d’itinéraires définis et et il est constitué de trois composants principaux: les microtubules, les filaments actiniques et les filaments intermédiaires. Les microtubules forment les avenues principales, où se passe la majeure partie des échanges de biomolécules et d’autres «marchandises». Par ailleurs, les microtubules jouent un rôle important dans la multiplication des cellules par division. Raison pour laquelle des chercheurs et chercheuses du PSI se sont spécialisés dans l’élucidation de leurs secrets.
Elucider les processus moléculaires
«Ce genre de structures et de processus dynamiques sont extrêmement complexes et donc difficiles à élucider à très haute résolution, explique Michel Steinmetz, responsable du Laboratoire de recherche biomoléculaire au PSI. A ce jour, nous ne comprenons qu’une fraction des processus moléculaires de notre corps, puisque les mécanismes biologiques décisifs se déroulent à une échelle minuscule, qui échappe largement à nos possibilités techniques d’investigation globale.»
Mais cela pourrait bientôt changer. Des procédés d’imagerie modernes à haute résolution, comme la microscopie cryoélectronique et la cristallographie aux rayons X, qui sont possibles avec les grandes installations de recherche du PSI, mettent les chercheurs et chercheuses en situation d’observer précisément les structures cellulaires et leurs interactions dynamiques avec d’autres biomolécules et substances. Et ce avec un niveau de détail de l’ordre de l’atome et une précision de l’ordre de la nanoseconde. Non seulement ces observations permettent d’élargir notre compréhension de l’organisme et de ses processus moléculaires, mais elles ouvrent aussi la porte au développement de nouveaux médicaments et traitements pour des personnes chez lesquelles les cellules ne fonctionnent pas comme elles le devraient. Des maladies comme le cancer, le Covid-19, le paludisme ou Alzheimer pourraient ainsi être mieux soignées.
Une dynamique vitale
Les microtubules sont surtout composés de deux types de tubulines – des protéines elles-mêmes constituées d’une chaîne de 450 acides aminés: la tubuline alpha et la tubuline bêta. Ces deux protéines forment des couples et s’enchaînent les unes aux autres en tubes minces. Chacun d’eux mesure une largeur de vingt-cinq nanomètres. Par comparaison, un cheveu humain est deux mille fois plus épais.
Le réseau de microtubules est très dynamique, comme si les rues étaient sans cesse raccourcies, élargies ou transformées. Sous le contrôle de différents partenaires de liaison et de mécanismes enzymatiques, les tubulines croissent et disparaissent au fil des ans, comme des plantes. En accéléré, cela donne ceci: les microtubules poussent dans une certaine direction à partir d’un centre d’organisation – leur racine, pour ainsi dire, qui se trouve au niveau du noyau cellulaire –, en s’arrimant constamment à de nouvelles tubulines. Parallèlement, des rangées entières se détachent pour éventuellement croître à nouveau dans une autre direction. Souvent, le microtubule se dissout complètement au bout de quelques minutes. Mais s’il rencontre une structure cible et devient partie intégrante d’une nouvelle rue fixe, il se stabilise et se maintient plus longtemps. «Cette dynamique du cytosquelette est très importante pour les processus les plus divers dans l’organisme», souligne Michel Steinmetz. Par exemple, pour la mitose et la méiose, autrement dit la division cellulaire qui revêt une importance cruciale pour la croissance et la reproduction de l’organisme. Le cytosquelette forme par ailleurs ce qu’on appelle le «fuseau mitotique» et sépare les uns des autres les supports du matériel génétique, c’est-à-dire les chromosomes. L’ADN se répartit ainsi de manière régulière de la cellule mère aux deux cellules filles. Enfin, le cytosquelette remplit des fonctions essentielles de cicatrisation, de différenciation des cellules souches et d’interconnexion des neurones dans le cerveau.
Des approches importantes en médecine
Différentes protéines motrices circulent au sein du réseau dynamique des rues, en faisant office de transporteurs. Les dynéines, par exemple, transportent des vésicules, des organelles cellulaires et d’autres particules venues de l’extérieur jusqu’au centre de la cellule. Mais ce faisant, les dynéines peuvent aussi introduire des agents pathogènes. Elles embarquent leur cargaison par couplage moléculaire et la transportent, en marchant comme sur des jambes, dans la rue des microtubules, à plus de cent pas par seconde. Cela représente une longueur de pas d’environ trois micromètres. Dans certaines cellules nerveuses, dont les axones mesurent plus d’un mètre de long, le transport peut durer jusqu’à douze jours.
Si des virus ou des parasites réussissent à tromper le contrôle d’accès de la membrane cellulaire, ils sont acheminés par taxi en direction du noyau cellulaire. Il suffit qu’un seul de ces intrus ait échappé au système immunitaire de la cellule, composé de peroxysomes et de lysosomes, pour qu’il introduise clandestinement son propre matériel génétique. La cellule va alors produire des virus en plus des cellules propres à l’organisme – et l’infection se répand.
Comprendre ce système dans ses moindres détails, sur le plan de la biologie structurale – la dynamique des microtubules, le mouvement des protéines motrices, les processus de couplage et de découplage des protéines de l’organisme avec des substances étrangères –, est désormais possible grâce aux procédés d’imagerie modernes. «Avec des installations comme la Source de Lumière Suisse SLS et le laser à rayons X à électrons libres SwissFEL, le PSI est bien présent dans ce domaine», affirme Michel Steinmetz. Et l’institut a déjà obtenu un certain nombre de succès.
Trouver les bonnes pièces du puzzle
Des membres du Laboratoire de recherche biomoléculaire ont ainsi décrit plus précisément vingt-sept points d’arrimage pour des substances actives sur la tubuline. Onze d’entre eux étaient complètement inconnus auparavant. Ce sont des cavités situées dans des chaînes d’acides aminés enroulées en pelote, où certaines liaisons moléculaires s’insèrent plus ou moins parfaitement comme les pièces d’un puzzle. On appelle aussi ces emplacements des «poches de liaison». Les chercheurs et chercheuses ont procédé à un criblage des fragments par cristallographie. Pour ce faire, ils ont imprégné un à un huit cents cristaux de tubuline avec une solution composée de huit cents fragments différents de molécules disponibles dans le commerce, en tant que substances actives standard. Cinquante-six fragments capables d’épouser les poches de liaison, du moins temporairement, ont pu être identifiés de cette façon. «Il s’agissait donc de composants potentiels pour un nouveau principe actif, puisqu’ils se lient à la tubuline», explique Andrea Prota, scientifique au Laboratoire de recherche biomoléculaire.
Il existe par exemple des substances qui enraient la dynamique de la tubuline et stoppent ainsi la division cellulaire. A l’instar du Taxol®, un médicament oncologique fréquemment utilisé, qui limite la prolifération des tumeurs, voire les fait diminuer. Mais le Taxol® est à l’origine une substance naturelle, obtenue à partir de l’écorce et des aiguilles de l’if du Pacifique. Comme cet arbre n’est pas très répandu et que sa teneur en Taxol® est réduite, il faut produire la substance de manière synthétique pour un usage plus large. Or, c’est une tâche très difficile en raison de la taille énorme de la molécule naturelle. Par ailleurs, le Taxol® provoque des effets indésirables. «La biologie structurale permet désormais de remplacer de telles substances par des molécules plus petites, dotées uniquement des caractéristiques propres à se lier à la tubuline, détaille Andrea Prota. Celles-ci possèdent par ailleurs un nouveau mécanisme d’action, sont plus faciles à manipuler et, avec un peu de chance, présenteront moins d’effets indésirables.»
Si un fragment correspondant est trouvé, il faut allonger sa durée de séjour dans la tubuline. Or, plus un principe actif reste longtemps arrimé – car, à tout moment, même les molécules correspondantes se redétachent –, mieux il peut déployer son effet. Plus une substance remplit bien la poche de liaison, mieux elle devrait y rester accrochée. Et c’est ainsi que les scientifiques cherchent à présent d’autres fragments avec lesquels compléter les premiers, pour qu’une fois combinés ils remplissent la poche de liaison de manière optimale. Pour cela, ils alimentent des ordinateurs avec les caractéristiques mesurées sur la poche de liaison découverte et sur le premier segment, avant de calculer la combinaison de fragments qui correspond le mieux. Comme un puzzle dont l’ordinateur connaît précisément toutes les pièces et propose les bonnes.
C’est de cette façon que les experts du PSI ont développé, avec l’Istituto Italiano di Tecnologia de Gênes, le principe actif Todalam. A la SLS, ils ont mesuré une des poches de liaison découvertes avec une précision de l’ordre de l’atome, puis ont combiné à l’ordinateur trois fragments correspondants pour former une molécule qui remplissait parfaitement la poche, comme l’ont confirmé des mesures ultérieures. En cultures cellulaires, les chercheurs et chercheuses ont ensuite démontré que le Todalam perturbait bel et bien, comme le Taxol®, la dynamique des microtubules dans les cellules et stoppait leur division. «Nos études ont été les premières à démontrer qu’il est possible de développer, à partir de fragments, des petites molécules qui inhibent les microtubules, explique Michel Steinmetz. Par ailleurs, le Todalam est facile à reproduire sur le plan chimique et à fabriquer en grande quantité. Maintenant, il faut montrer qu’un médicament oncologique novateur est développable.»
Dans une nouvelle étude publiée en début d’année, les scientifiques de l’équipe de Jörg Standfuss ont réalisé un film à ultra-haute résolution temporelle et spatiale avec le SwissFEL. Celui-ci montre comment un principe actif – en l’occurrence le médicament anticancéreux Combrétastatine A-4, actuellement testé dans des études cliniques –, qui se trouve dans la poche de liaison, s’en détache et comment la molécule du principe actif et la poche se déforment. «La connaissance précise de ces processus, que nous avons rendus visibles pour la première fois, explique Jörg Standfuss du Laboratoire de recherche biomoléculaire, améliore nos possibilités de concevoir de nouveaux principes actifs de manière adaptée, de sorte que la durée de liaison et l’efficacité augmentent.»
Un effet ciblé est requis
Une difficulté persiste toutefois: comment créer de nouveaux principes actifs qui affectent et bloquent uniquement les cellules cancéreuses et non les cellules saines? Ce manque de spécificité est en effet responsable d’une bonne partie des effets indésirables.
On est déjà plus avancé dans le domaine de la défense contre les parasites unicellulaires qui cherchent à envahir l’organisme. Là aussi, les scientifiques du Laboratoire de recherche biomoléculaire appliquent le principe consistant à stopper la dynamique de la tubuline des cellules ennemies et à les empêcher ainsi de se diviser.
Par comparaison avec la lutte contre la prolifération des cellules cancéreuses, l’avantage est que les tubulines des parasites sont de nature légèrement différente de celles des êtres humains. C’est un aspect que l’on pouvait déjà déduire de leur séquence d’acides aminés, mais qui a pu être confirmé par l’imagerie à haute résolution. Natacha Gaillard et Ashwani Sharma, scientifiques au PSI, ont analysé les tubulines des cellules du cilié Tetrahymena thermophila. Celles-ci sont quasiment identiques aux tubulines des agents pathogènes du paludisme du genre Plasmodium et de l’agent pathogène de la toxoplasmose Toxoplasma gondii. Au niveau des atomes, les deux scientifiques ont constaté des différences structurelles claires avec les tubulines humaines. En passant en revue une base de données de substances actives, ils ont ensuite identifié cinq candidats qui pourraient se lier de manière ciblée à cette forme de tubuline. L’un d’entre eux a été couronné de succès lors des essais. Natacha Gaillard et Ashwani Sharma ont baptisé ce composé «parabuline».
Des partenaires de coopération de l’University of California, aux Etats-Unis, ont testé la parabuline dans des cultures de cellules humaines contaminées par Toxoplasma gondii. Et, effectivement, le parasite ne pouvait plus se reproduire, alors que les cellules humaines échappaient pratiquement à son influence. «La parabuline était capable d’empêcher non seulement l’invasion de la cellule par les parasites, mais aussi la reproduction à l’intérieur de la cellule», raconte Natacha Gaillard. Cela fonctionne probablement avec d’autres parasites, l’hypothèse est actuellement testée. «Mais à cette fin, il faudra sûrement adapter diverses variantes de parabulines en termes de biologie structurale», note la chercheuse.
Pour poursuivre dans cette voie, Natacha Gaillard et Ashwani Sharma ont déposé un brevet et fondé la start-up ASTRA Therapeutics. Leur objectif est de développer des parabulines spécifiques à l’espèce, qui puissent être utilisées de manière ciblée contre le paludisme, la toxoplasmose et d’autres parasites.
Au PSI, Natacha Gaillard et Ashwani Sharma font actuellement avancer la recherche fondamentale sur ce sujet: «Plus nous connaissons précisément la manière dont les parasites abusent le cytosquelette et ses fonctions pour atteindre leurs propres objectifs, mieux nous pourrons les traiter de manière ciblée», souligne Natacha Gaillard. Ils cherchent par exemple à découvrir avec quelle protéine, où et comment le parasite s’arrime au microtubule. Cela permettrait de bloquer la liaison du côté du parasite ou de l’hôte, ou encore de les empêcher de se trouver.
Des nageoires et un tapis roulant de microtubules
Des scientifiques, emmenés par Takashi Ishikawa, chef de groupe au Laboratoire de biologie à l’échelle nanométrique du PSI, sont sur la piste d’autres maladies graves et de nouveaux traitements. Ils mènent des recherches sur les cils et les flagelles. Ce sont de fins prolongements que l’on retrouve sur de nombreuses cellules et qui sont également faits de microtubules. Représentant pour ainsi dire des dérivés du cytosquelette, ils assument toutes sortes de fonctions dans l’organisme.
Nous les connaissons par exemple chez le spermatozoïde, propulsé par un flagelle à la manière d’une nageoire, lorsqu’il cherche son chemin vers l’ovule. Certains organismes unicellulaires, comme l’algue verte Chlamydomonas, disposent également de deux flagelles qu’ils utilisent pour se déplacer. Les muqueuses de notre gorge et de notre nez sont, quant à elles, parsemées de tapis entiers de ce genre de filaments. On les appelle alors «cils». «En fait, ils ne se distinguent pas des flagelles», explique Takashi Ishikawa. Ils bougent eux aussi de manière rythmique et acheminent les substances nocives inhalées et liées au mucus depuis les poumons jusqu’à la trachée et au pharynx, comme sur un tapis roulant. Là, elles sont avalées et éliminées dans l’estomac. Dans le nez, les cellules olfactives transportent également les molécules odorantes de cette manière. Idem pour les cellules cérébrales qui apportent le liquide céphalorachidien. Les cils jouent même un rôle important dans le développement des embryons: leur mouvement – décisif pour la différenciation des organes et leur répartition asymétrique dans le corps – est alors celui d’une toupie. Il arrive que ce mouvement gyroscopique se passe en sens inverse. Chez les personnes concernées, les organes sont alors inversés et le coeur, par exemple, bat à droite. C’est ce que les spécialistes appellent le «situs inversus».
Il existe d’innombrables maladies qui sont liées à la défaillance des cils. Celles-ci peuvent par exemple rendre les hommes et les femmes stériles. Les hommes, parce que leurs spermatozoïdes n’avancent pas correctement, et les femmes, parce que leurs ovules ne sont pas bien acheminés dans les trompes par des cils. Certaines lésions cérébrales et diverses maladies pulmonaires font partie de ce qu’on appelle les «ciliopathies». La dyskinésie ciliaire primitive (DCP), dont souffrent un demi-million d’individus dans le monde, touche non seulement les voies respiratoires, mais s’accompagne aussi, dans la moitié des cas, d’un situs inversus.
Des défauts de protéines en sont le fondement. Plus de 400 gènes sont impliqués dans le mouvement des cils. Du moins pour ceux qui ont été identifiés jusqu’ici. «Mais on ignore encore comment les protéines le contrôlent précisément», note Takashi Ishikawa, qui aimerait changer la donne.
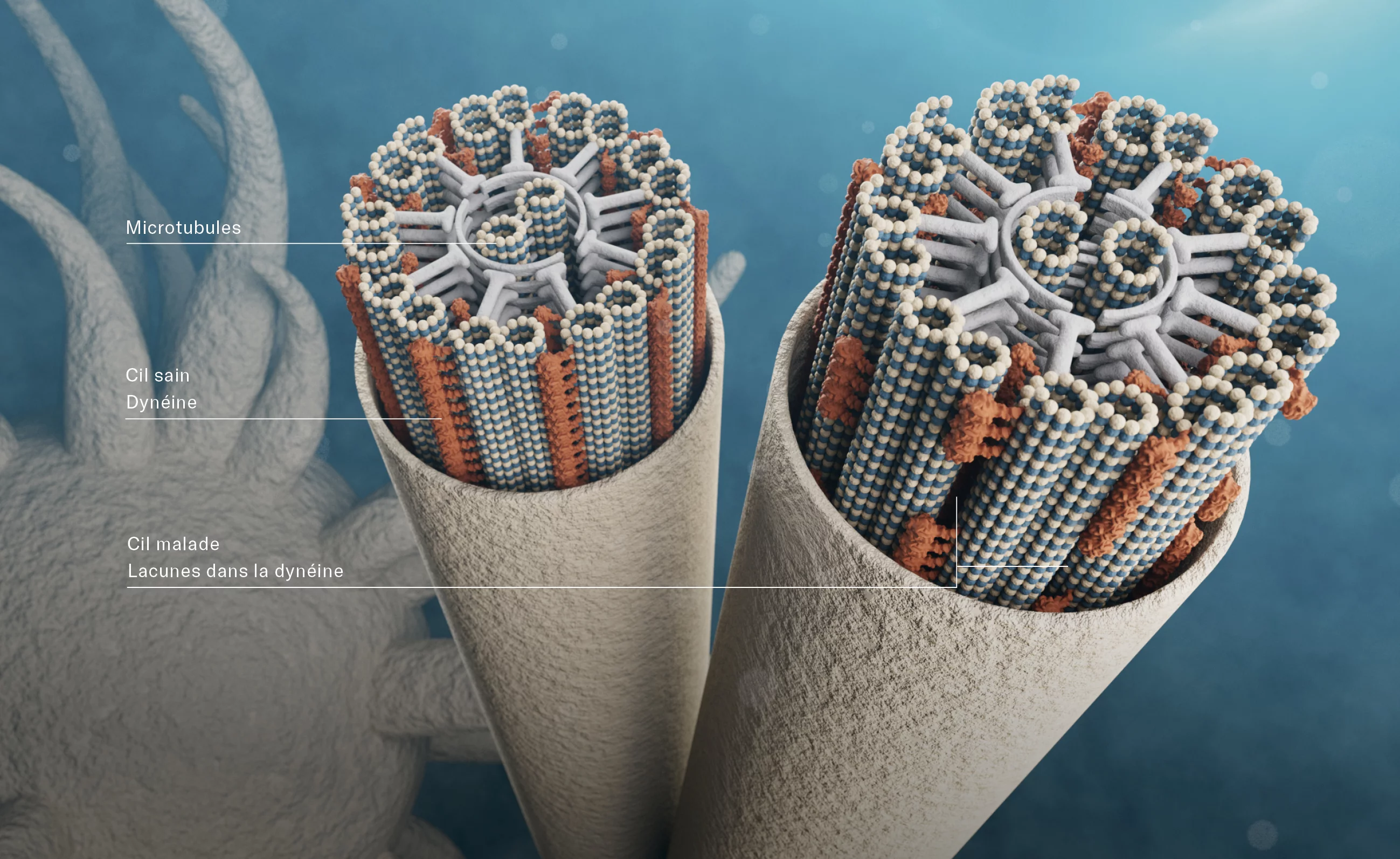
Une mystérieuse courbure
Les cils sont composés d’une structure tubulaire de microtubules. Deux microtubules individuels, au centre, sont entourés de neuf doublets, formés chacun de deux tubes de microtubules fusionnés. La cohésion est assurée par des protéines radiales, de la même façon que les rayons d’une roue relient le moyeu et le pneu. Entre les microtubules extérieurs, des protéines de dynéine sont présentes sur toute la longueur: ces protéines motrices se déplacent sur les microtubules. Des études menées au PSI ont montré qu’avec l’ATP comme source d’énergie (ce «carburant» qu’est l’adénosine-triphosphate) elles font glisser les différents doublets d’avant en arrière, dans le sens de la longueur, un peu comme des mains qui se frottent. «Mais nous devons encore découvrir exactement comment ce glissement induit la courbure du cil», explique Takashi Ishikawa.
Dans le cadre d’une nouvelle étude, son équipe a démontré à l’aide de microscopes cryoélectroniques que le complexe protéique de dynéine ne se présentait pas de la même manière avant et après avoir clivé l’ATP. Les acides aminés dont il est composé se réarrangent au niveau moléculaire. «Nous supposons qu’il s’agit de la force motrice qui se trouve là-derrière», dit Takashi Ishikawa. Mais, ce faisant, son équipe n’a considéré qu’une petite partie de l’appareil ciliaire. «Nous devons encore en étudier beaucoup d’autres parties pour identifier les interactions et caractériser l’ensemble du mécanisme», relève encore le chercheur. Les modifications de structure de la dynéine le long du cil se distinguent et s’influencent sans doute mutuellement, en suivant un certain mécanisme, et finissent par induire le mouvement.
Cela durera des années avant que le tableau ne soit complet. Mais les études d’aujourd’hui ont déjà une utilité concrète: les chercheurs et chercheuses du PSI coopèrent avec l’Hôpital de l’Ile de l’Université de Berne, qui leur fournit des échantillons de tissus prélevés sur des patients atteints de DCP. Les prises de vues à ultra-haute résolution de leurs cils montrent qu’il existe souvent de grosses lacunes au niveau de l’équipement en dynéine des filaments et, chez certains, la dynéine est même complètement absente. Or, dans le cas de la DCP, plusieurs années s’écoulent entre les premiers symptômes et le moment où l’on consulte son médecin pour des problèmes respiratoires aigus et où un diagnostic est posé. Soit un temps précieux, avant que l’on ne puisse intervenir. «Cette période pourrait être considérablement réduite si l’on procédait au contrôle visuel de routine des cils», affirme Takashi Ishikawa.
De nouveaux moyens pour des corrections ciblées
Comme ces exemples le montrent, les nouvelles méthodes d’imagerie des processus moléculaires qui se passent dans notre corps promettent de grands progrès. Et elles rendent humble: «Lorsqu’on voit à quel point tous ces processus sont reliés en filigrane, dynamiques et finement équilibrés, cela vous impose le respect en tant que chercheur, souligne Michel Steinmetz. Ce que la biologie nous révèle petit à petit reste, pour nous, très difficile à saisir dans toute sa complexité. C’est une vraie merveille. Toujours est-il que les nouvelles méthodes dont nous disposons ici, au PSI, permettent d’en comprendre davantage. Et, potentiellement, de procéder à des corrections plus ciblées, au cas où quelque chose au sein du système devrait mal tourner.»
Texte: Jan Berndorff
Droit à l'utilisation
Le PSI fournit gratuitement des images et/ou du matériel vidéo pour la couverture médiatique du contenu du texte ci-dessus. L'utilisation de ce matériel à d'autres fins n'est pas autorisée. Cela inclut également le transfert des images et du matériel vidéo dans des bases de données ainsi que la vente par des tiers.