In jeder unserer Körperzellen befindet sich ein Netzwerk aus feinsten Fäden: das sogenannte Zellskelett. Anders als sein Name vermuten lässt, ist es weitaus mehr als eine reine Stützstruktur. Es übernimmt viele lebenswichtige Funktionen. Deshalb stellt es ein vielversprechendes Forschungsgebiet der Biologie sowie Medizin dar und bietet zahlreiche Ansatzpunkte für neuartige Therapien.
Jedes Lebewesen besteht zumindest aus einer Zelle, der Grundeinheit allen Lebens. Die allermeisten Pflanzen und Tiere setzen sich aus einer Vielzahl von Zellen zusammen – der Mensch zum Beispiel aus rund dreissig Billionen. Schon die einzelne Zelle ist ein enorm komplexes Gebilde. Um seine Funktionsweise besser verständlich zu machen, greifen Lehrende oft zu einer Analogie: dem idealtypischen Modell eines Stadtstaates. Der Zellkern, in dem sich der Grossteil des Erbmaterials befindet – also die Blaupausen wesentlicher Bausteine der Zelle –, bildet das Regierungsviertel. Hier werden die Regeln bestimmt, nach denen das gesamte Gebilde funktioniert. Ribosomen stellen die Fabriken dar, die gemäss der in der Zentrale gespeicherten Baupläne – den Genen – alles bauen, was in der Stadt so gebraucht wird, darunter Zigtausende Sorten unterschiedlicher Proteine. Diese sowie von aussen angelieferte Nährstoffe, Signalstoffe und weitere Substanzen werden in sogenannten Vesikeln, kleinen Tröpfchen, von einem Ort zum nächsten transportiert – wie Pakete bei der Post. Die Transporter sind sogenannte Motorproteine. Sie befördern die Pakete zu ihren Bestimmungsorten – den verschiedenen Einrichtungen der Stadt.
Neben dem Zellkern-Regierungsviertel gibt es unter anderem die Mitochondrien. Wie Kraftwerke liefern sie, indem sie aus den eintreffenden Nährstoffen den Treibstoff Adenosintriphosphat (ATP) produzieren, die Energie, die alles am Laufen hält. Es existiert eine Art Versandhaus, in dem die Waren der Fabriken für den Transport aufbereitet werden – Golgi-Apparat genannt. Es gibt Kontrollstationen an der Stadtmauer (Zellmembran) und den Toren (Membrankanäle und Transporter), die eine Einlasskontrolle bei externen Waren durchführen. Die Polizei (Peroxisome) verhaftet unerwünschte Eindringlinge und führt sie ab, oft in Zusammenarbeit mit der Müllabfuhr (Lysosome), welche Reststoffe entsorgt.
Grundlegende Voraussetzungen für die Funktion der Zelle sind der bereits erwähnte Warentransport und der Informationsaustausch. Beide spielen sich meist auf den Strassen der Stadt ab, die in einem weitverzweigten Netz alles verbinden. Diesem Strassennetz entspricht in der Zelle ein Teil des sogenannten Zellskeletts. Dieses ist unter anderem für den Transport von Zellbestandteilen entlang definierter Routen verantwortlich und es besteht aus drei Hauptkomponenten: Mikrotubuli, Aktin- und Intermediärfilamenten. Mikrotubuli sind quasi die Hauptstrassen. Auf ihnen findet der Grossteil des Austauschs von Biomolekülen und anderer «Waren» statt. Zudem spielen sie eine essenzielle Rolle bei der Zellteilung. Forschende des PSI haben sich deshalb darauf spezialisiert, die Geheimnisse dieser Mikrotubuli zu lüften.
Aufklärung molekularer Vorgänge
«Solche dynamischen Strukturen und Vorgänge sind hoch komplex und deshalb bei sehr hoher Auflösung nur sehr schwierig aufzuklären», sagt Michel Steinmetz, Leiter des Labors für biomolekulare Forschung am PSI. «Wir verstehen bislang nur einen Bruchteil aller molekularen Prozesse unseres Körpers, da sich die entscheidende Biologie auf einer winzigen Skala abspielt, die sich unseren technischen Möglichkeiten für allumfassende Untersuchungen bisher weitgehend entzieht.»
Doch dies könnte sich demnächst ändern. Moderne, hochauflösende Bildgebungsverfahren wie die Kryo-Elektronenmikroskopie und die Röntgenkristallografie, die unter anderem mit Grossforschungsanlagen wie denen des PSI möglich sind, versetzen Forschende in die Lage, Zellstrukturen und deren dynamische Interaktionen mit anderen Biomolekülen und Substanzen exakt zu beobachten – und das in atomarer Detailtiefe und auf die Nanosekunde genau. Das erweitert nicht nur unser Verständnis des Organismus und der in ihm stattfindenden molekularen Vorgänge, sondern öffnet auch die Tür zur Entwicklung neuer Medikamente und Behandlungen für Menschen, bei denen die Zellen nicht wie gewohnt funktionieren. Krankheiten wie Krebs, Covid-19, Malaria und Alzheimer könnten besser therapierbar werden.
Lebenswichtige Dynamik
Mikrotubuli bestehen vor allem aus zwei Sorten von Tubulinen – Proteinen, die wiederum aus jeweils rund 450 verketteten Aminosäuren aufgebaut sind: Alpha- und Beta-Tubulin. Die beiden Proteine bilden Paare und ketten sich zu dünnen Röhren aneinander. Jede davon ist ganze fünfundzwanzig Nanometer breit, ein normales menschliches Kopfhaar ist etwa 2000 Mal dicker.
Das Geflecht der Mikrotubuli ist sehr dynamisch, als würden die Strassen ständig gekürzt, aus- oder umgebaut. Gesteuert von verschiedenen Bindungspartnern und enzymatischen Mechanismen wachsen und vergehen die Tubuline wie Pflanzen über die Jahre. Allerdings im Zeitraffer: Die Mikrotubuli wachsen von einem sogenannten Mikrotubulus- Organisationszentrum – quasi ihrer Wurzel, die beim Zellkern liegt – in eine bestimmte Richtung, indem laufend neue Tubuline andocken. Jedoch fallen auch ständig ganze Reihen wieder ab, nur um dann womöglich in eine andere Richtung erneut zu wachsen. Oft löst sich der Mikrotubulus schon nach wenigen Minuten ganz auf. Trifft er aber auf eine Zielstruktur und wird Bestandteil einer festen neuen Strasse, so stabilisiert er sich und bleibt länger erhalten. «Diese Dynamik des Zellskeletts ist für verschiedenste Prozesse im Körper unheimlich wichtig», sagt Michel Steinmetz. Zum Beispiel bei der Mitose und Meiose – der Zellteilung, die für Wachstum und Fortpflanzung des Organismus von zentraler Bedeutung ist. Das Zellskelett bildet dazu den sogenannten Spindelapparat und zieht die Träger der Erbsubstanz, die Chromosomen, auseinander. So verteilt sich die DNA von der Mutterzelle gleichmässig auf die beiden Tochterzellen. Darüber hinaus erfüllt das Zellskelett wichtige Funktionen bei der Wundheilung, der Differenzierung von Stammzellen oder der Vernetzung der Neuronen im Gehirn.
Wichtige Ansätze für die Medizin
Auf dem dynamischen Strassennetz verkehren verschiedene Motorproteine als Transporter. Dyneine Comzum Beispiel übernehmen den Transport von Vesikeln sowie Zellorganellen und anderen Partikeln aus den Aussenbereichen ins Zentrum der Zelle – und können so auch Krankheitserreger einschleppen. Sie nehmen ihre Fracht per molekulare Kopplung huckepack und tragen sie wie auf Beinen über die Mikrotubulistrasse – mit mehr als hundert Schritten pro Sekunde. Das sind bei ihrer Schrittlänge rund drei Mikrometer. In manchen Nervenzellen, deren Axone über einen Meter lang sein können, dauert ein Transport daher schon mal bis zu zwölf Tage.
Wenn es nun Viren oder Parasiten gelingt, die Einlasskontrolle der Zellmembran zu überlisten, nehmen auch sie dieses Taxi Richtung Zellkern. Bleibt nur ein Einziger dieser Eindringlinge auch vom zelleigenen Immunsystem aus Peroxisomen und Lysosomen unbemerkt, so kann er sein eigenes Erbgut einschleusen. Dann produziert die Zelle fortan Viren zusätzlich zu körpereigenen Proteinen. Die Infektion greift um sich.
Dieses System bis aufs kleinste Detail strukturbiologisch zu verstehen – die Dynamik der Mikrotubuli, die Bewegung der Motorproteine, die Kopplungs- und Entkopplungsprozesse der körpereigenen Proteine mit Fremdstoffen –, wird nun mit modernen Bildgebungsverfahren möglich. «Mit Anlagen wie der Synchrotron Lichtquelle Schweiz SLS und dem Freie-Elektronen-Röntgenlaser SwissFEL ist das PSI in diesem Feld sehr stark vertreten», sagt Steinmetz, und hat auch schon einige Erfolge erzielt.
Passende Puzzleteile finden
So haben Forschende des Labors für biomolekulare Forschung am Tubulin siebenundzwanzig Andockstellen für Wirkstoffe genauer beschrieben, von denen elf zuvor völlig unbekannt waren. Das sind quasi Vertiefungen in den zu einem Knäuel verwobenen Aminosäureketten, in die manch molekulare Verbindung mehr oder weniger perfekt hineinpasst wie ein Puzzlestück. Man nennt diese Stellen auch «Bindungstaschen». Die Forschenden führten ein kristallografisches Fragmente-Screening durch. Dabei tränkten sie 800 Tubulinkristalle einzeln jeweils mit Lösungen bestehend aus 800 verschiedenen Molekülfragmenten, welche als Standard-Wirkstoffe kommerziell erhältlich sind. Sechsundfünfzig Fragmente konnten sie auf diese Weise identifizieren, die sich zumindest vorübergehend in die Bindungstaschen schmiegten. «Das wären also mögliche Bausteine für einen neuen Wirkstoff, weil sie an das Tubulin binden», erklärt Andrea Prota, ein Wissenschaftler im Labor für biomolekulare Forschung.
Zum Beispiel gibt es Substanzen, die die Dynamik des Tubulins und damit die Zellteilung stoppen. Das häufig eingesetzte Krebsmedikament Taxol® etwa dämmt so das Wuchern von Tumoren ein oder lässt sie sogar schrumpfen. Allerdings ist Taxol® ursprünglich ein Naturstoff, der aus der Rinde und den Nadeln der pazifischen Eibe gewonnen wird. Da diese Baumart nicht weit verbreitet und der Taxolgehalt gering ist, muss man den Stoff für eine breite Anwendung synthetisch herstellen. Dies wiederum ist wegen der enormen Grösse des natürlichen Moleküls sehr schwierig. Zudem provoziert Taxol® unerwünschte Nebenwirkungen. «Die Strukturbiologie ermöglicht uns nun, solche Substanzen massgeschneidert durch kleinere Moleküle zu ersetzen, die nur die notwendigen Merkmale haben, um an das Tubulin zu binden», sagt Prota. «Sie besitzen ausserdem einen neuen Wirkmechanismus, sind leichter zu handhaben und zeigen mit etwas Glück hoffentlich auch weniger Nebenwirkungen.»
Wird ein passendes Fragment gefunden, gilt es, seine Verweildauer am Tubulin zu erhöhen. Denn je länger ein Wirkstoff gebunden bleibt – irgendwann lösen sich auch passende Moleküle wieder – desto mehr Wirkung kann sich entfalten. Je besser eine Substanz die Bindungstasche ausfüllt, desto länger sollte sie sich darin festhalten. Und so suchen die Forschenden nun nach weiteren Fragmenten, mit denen sie das erste ergänzen können, sodass sie in Kombination die Bindungstasche optimal ausfüllen. Dazu füttern sie den Computer mit den gemessenen Merkmalen der gefundenen Bindungstasche sowie des ersten Fragments und berechnen, welche Fragment- Kombination optimal passt. Wie bei einem Puzzle, für das der Computer alle Teile genau kennt und die richtigen vorschlägt.
Auf diese Weise haben die PSI-Fachleute zusammen mit dem Istituto Italiano di Tecnologia in Genua den Wirkstoff Todalam entwickelt. Sie vermassen eine der gefundenen Bindungstaschen atomgenau mit der SLS und kombinierten im Computer drei passende Fragmente zu einem Molekül, das die Tasche perfekt ausfüllt – wie erneute Messungen bestätigten. In Zellkulturen haben die Forschenden dann nachgewiesen, dass Todalam tatsächlich wie Taxol® die Dynamik der Mikrotubuli in Zellen stört und so deren Teilung stoppt. «Unsere Studien haben zum ersten Mal gezeigt, dass es möglich ist, aus Fragmenten massgeschneiderte Kleinmoleküle zu entwickeln, welche Mikrotubuli hemmen », sagt Steinmetz. «Zudem ist Todalam leicht chemisch nachzubauen und in grossen Mengen herzustellen. Nun gilt es zu zeigen, dass sich daraus ein neuartiges Krebsmedikament entwickeln lässt.»
In einer neuen, Anfang dieses Jahres veröffentlichten Studie haben Forschende um Jörg Standfuss mit dem SwissFEL quasi einen Film in zeitlich wie räumlich ultrahoher Auflösung gemacht. Er zeigt, wie ein Wirkstoff – in diesem Fall das aktuell in klinischen Studien getestete Krebsmedikament Combretastatin A-4 –, der sich in der Bindungstasche befindet, wieder von ihr löst und wie sich dabei sowohl das Wirkstoffmolekül als auch die Tasche verformt. «Die genaue Kenntnis dieser Vorgänge, die wir nun erstmals sichtbar gemacht haben», erklärt Standfuss vom Labor für Biomolekulare Forschung, «verbessert unsere Möglichkeiten, neue Wirkstoffe passgenauer zu gestalten, sodass sich Bindedauer und Wirksamkeit erhöhen.»
Zielgenaue Wirkung ist gefragt
Eine Schwierigkeit bleibt allerdings, wie man neue Wirkstoffe so entwirft, dass sie nur kranke Zellen treffen und diese blockieren, nicht aber gesunde Zellen – denn das provoziert grossteils die unerwünschten Nebenwirkungen.
Bei der Abwehr einzelliger Parasiten, die den Körper befallen wollen, ist man bereits weiter. Auch hier wenden Forschende des Labors für biomolekulare Forschung das Prinzip an, die Dynamik des Tubulins der feindlichen Zellen zu stoppen und diese so daran zu hindern, sich zu teilen. Der Vorteil im Vergleich zur Bekämpfung wuchernder Krebszellen: Die Tubuline der Parasiten sind etwas anders beschaffen als die menschlichen. Dies liess sich anhand ihrer Aminosäuresequenz bereits ablesen und konnte durch die hochauflösende Bildgebung bestätigt werden. Die PSI-Forschenden Natacha Gaillard und Ashwani Sharma haben Tubuline aus den Zellen des unscheinbaren Wimperntierchens Tetrahymena thermophila analysiert. Sie sind quasi identisch mit den Tubulinen der Malariaerreger der Gattung Plasmodium und des Erregers der Toxoplasmose Toxoplasma gondii. Auf atomarer Ebene stellten die Forschenden klare strukturelle Unterschiede zu menschlichen Tubulinen fest. Dann identifizierten sie per Screening in einer Wirkstoff-Datenbank fünf Kandidaten für Wirkstoffe, die gezielt an diese Form von Tubulin binden könnten. Einer erwies sich in Versuchen als Treffer. Gaillard und Sharma tauften die Verbindung «Parabulin».
Kooperationspartner an der University of California in den USA testeten Parabulin in Kulturen mit menschlichen Zellen, die von Toxoplasma gondii befallen waren. Und tatsächlich konnte sich der Parasit nicht mehr vermehren, während die menschlichen Zellen so gut wie unbeeinflusst blieben. «Das Parabulin konnte sowohl die Invasion der Zelle durch Toxoplasmodien verhindern als auch ihre Vermehrung innerhalb der Zelle», berichtet Gaillard. Wahrscheinlich funktioniere das auch bei anderen Parasiten, das werde aktuell getestet. «Sicher müssen dafür aber verschiedene Parabulin-Varianten strukturbiologisch massgeschneidert werden.»
Um diesen Weg weiterzugehen, haben Gaillard und Sharma ein Patent angemeldet und das Startup ASTRA Therapeutics gegründet. Dort wollen sie nun Spezies-spezifische Parabuline entwickeln, die gezielt gegen Malaria, Toxoplasmose und auch andere Parasiten eingesetzt werden können.
Am PSI treiben Gaillard und Sharma derweil die Grundlagenforschung zum Thema voran: «Je präziser wir die Vorgänge kennen, wie Parasiten das Zellskelett und seine Funktionen für ihre Zwecke missbrauchen, desto gezielter können wir behandeln », sagt Gaillard. Sie wollen etwa herausfinden, mit welchem Protein ein Parasit wo und wie am Mikrotubulus andockt. Womöglich könnte man dann die Bindung aufseiten des Parasiten oder des Wirts blockieren oder von vornherein verhindern, dass sie einander finden.
Flossen und Förderbänder aus Mikrotubuli
Anderen schweren Krankheiten und neuen Therapien auf der Spur sind Forschende um Takashi Ishikawa, Gruppenleiter am PSI-Labor für Biologie im Nanobereich. Sie erforschen Zilien und Flagellen. Dies sind fadenartige Fortsätze vieler Zellen, die ebenfalls aus Mikrotubuli bestehen, gewissermassen Auswüchse des Zellskeletts darstellen, und vielerlei Funktionen im Körper erfüllen.
Wir kennen sie zum Beispiel vom Spermium, das von einem Flagellum flossenartig angetrieben wird, wenn es seinen Weg zur Eizelle sucht. Manche Einzeller wie etwa die Grünalge Chlamydomonas verfügen auch über zwei Flagellen, die sie zur Fortbewegung nutzen. Die Schleimhäute in unserem Rachen und in der Nase sind sogar von ganzen Teppichen solcher Fäden übersät. In solchen Fällen nennt man sie «Zilien». «Sie unterscheiden sich im Einzelnen aber eigentlich nicht von Flagellen», sagt Ishikawa. Auch sie bewegen sich rhythmisch hin und her und transportieren im Schleim gebundene, eingeatmete Schadstoffe wie auf einem Förderband aus der Lunge in Richtung Luftröhre und Rachen. Dort werden sie geschluckt und so im Magen entsorgt. In der Nase transportieren die Riechzellen auf diese Weise auch Duftmoleküle. Gehirnzellen befördern so die Gehirnflüssigkeit. Sogar bei der Entwicklung von Embryos spielen Zilien eine wichtige Rolle: Hier beschreibt ihre Bewegung einen Kreisel, was entscheidend für die Differenzierung der Organe und deren asymmetrische Verteilung im Körper ist. Es kommt zum Beispiel vor, dass die Kreiselbewegung in umgekehrter Richtung verläuft. Bei Betroffenen sind die Organe dann seitenverkehrt angeordnet, das Herz etwa schlägt rechts. Situs inversus nennen Fachleute das.
Es gibt zahllose Erkrankungen, die mit Fehlfunktionen der Zilien zusammenhängen: Zum Beispiel können sowohl Männer als auch Frauen dadurch unfruchtbar sein. Männer, weil die Spermien nicht richtig vorwärtskommen, und Frauen, weil die Eier im Eileiter ungenügend von Zilien befördert werden. Auch Hirnschäden und verschiedene Lungenerkrankungen gehören zu den sogenannten Ziliopathien. Die Primäre Ciliäre Dyskinesie (PCD), unter der weltweit etwa eine halbe Million Menschen leiden, betrifft nicht nur die Atemwege, sondern geht in der Hälfte der Fälle auch mit Situs inversus einher.
Zugrunde liegen Proteindefekte. Über 400 Gene sind an der Bewegung der Zilien beteiligt – so viel hat man schon herausgefunden. «Aber wie genau die Proteine das steuern, ist noch unbekannt», sagt Ishikawa. Das möchte er ändern.
Geheimnisvolle Biegung
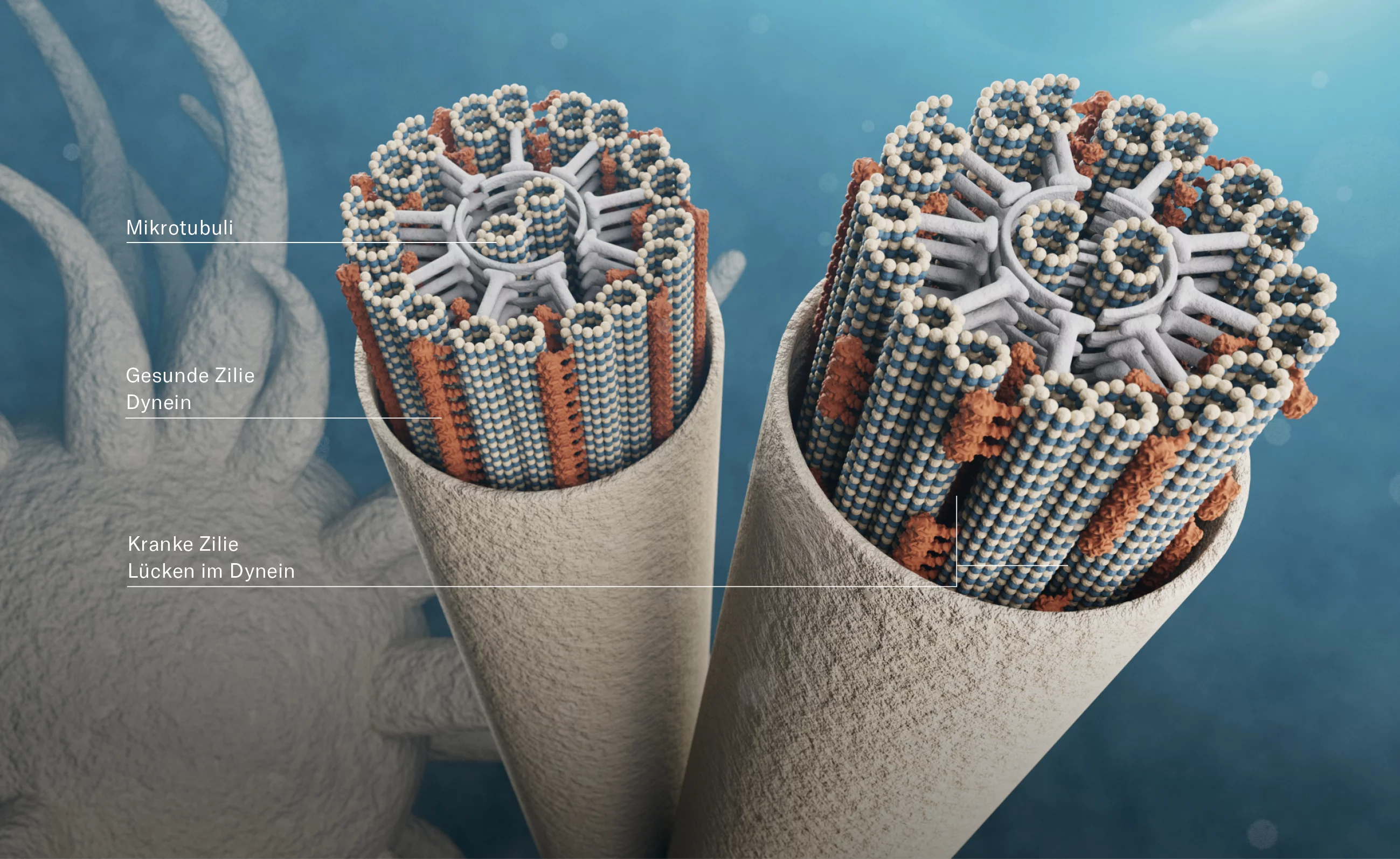
Zilien bestehen aus einem röhrenförmigen Gerüst aus Mikrotubuli: Zwei einzelne Mikrotubuli im Zentrum werden von neun Dubletts umgeben, die ihrerseits aus jeweils zwei verschmolzenen Mikrotubuliröhrchen bestehen. Für den Zusammenhalt sorgen Radialproteine – so wie bei einem Rad die Speichen Nabe und Reifen verbinden. Zwischen den äusseren Mikrotubuli stecken auf der ganzen Länge Dynein- Proteine – also jene Motorproteine, die auf den Mikrotubuli unterwegs sind. Untersuchungen am PSI haben nun gezeigt, dass sie mit ATP, also dem «Treibstoff» Adenosintriphosphat, als Energiequelle die einzelnen Dubletts dazu bringen, sich längs vor- und zurückzuschieben – ähnlich wie Hände, die sich aneinander reiben. «Wie diese Gleitbewegung allerdings genau dazu führt, dass sich die Zilie biegt, müssen wir noch herausfinden», sagt Ishikawa.
In einer neuen Studie hat sein Team mithilfe von Kryo-Elektronenmikroskopen gezeigt, dass der Dynein-Proteinkomplex, nachdem er das ATP gespalten hat, anders aussieht als vorher. Die Aminosäuren, aus denen er besteht, arrangieren sich also molekular um. «Wir vermuten, dass dies die treibende Kraft dahinter ist», so Ishikawa. Damit habe sein Team aber nur einen kleinen Teil des gesamten Zilienapparats betrachtet. «Wir müssen noch viele weitere Teile untersuchen, um Zusammenhänge zu erkennen und den gesamten Mechanismus zu charakterisieren.» Vermutlich unterscheiden sich die Strukturveränderungen des Dyneins entlang der Zilie, sodass sie einander in einer gewissen Mechanik beeinflussen und die Bewegung hervorrufen.
Es wird noch Jahre dauern, bis das Bild davon komplett ist. Einen konkreten Nutzen haben die Studien aber schon heute: Die PSI-Forschenden kooperieren mit dem Inselspital der Universität Bern, von dem sie Gewebeproben von PCD-Patienten erhalten. Die ultrahochauflösenden Aufnahmen ihrer Zilien zeigen, dass im Dyneinbesatz der Filamente oft grosse Lücken existieren, an manchen fehlt das Dynein sogar komplett. Nun ist es so, dass bei einer PCD-Erkrankung von den ersten Symptomen bis zu dem Zeitpunkt, da man wegen akuter Atemprobleme zum Arzt geht und eine Diagnose erhält, mehrere Jahre liegen. Es vergeht also wertvolle Zeit, bevor eingegriffen werden kann. «Diese könnte man durch eine routinemässige optische Überprüfung der Zilien erheblich verkürzen», sagt Ishikawa.
Neue Mittel für gezielte Korrekturen
Die Beispiele zeigen: Die Erforschung der molekularen Vorgänge in unserem Körper mit den neuen Methoden der Bildgebung verspricht grosse Fortschritte. Und sie steigert die Demut. «Wenn man sieht, wie filigran verknüpft, dynamisch und fein austariert all diese Prozesse sind, wird man als Forscher ehrfürchtig», sagt Michel Steinmetz. «Was die Biologie uns da nun alles Stück für Stück preisgibt, ist für uns in all seiner Komplexität kaum zu erfassen – ein wahres Wunderwerk. Immerhin ermöglichen uns die neuen Methoden, die uns hier am PSI zur Verfügung stehen, etwas mehr davon zu verstehen – und eventuell gezieltere Korrekturen vorzunehmen, falls in dem System mal etwas schiefläuft.»
Text: Jan Berndorff
Nutzungsrechte
Das PSI stellt Bild- und/oder Videomaterial für eine Berichterstattung über den Inhalt des obigen Textes in den Medien kostenfrei zur Verfügung. Eine Verwendung dieses Materials für andere Zwecke ist nicht gestattet. Dazu gehören auch die Übernahme des Bild- und Videomaterials in Datenbanken sowie ein Verkauf durch Dritte.