Les ordinateurs à haute performance modernes et l’intelligence artificielle aident à déchiffrer les causes des maladies et à améliorer les diagnostics ainsi que les traitements.
Celles et ceux qui étudient les structures moléculaires avec de grandes installations de recherche – telles que la Source de Lumière Suisse SLS ou le laser suisse à rayons X à électrons libres SwissFEL – doivent traiter d’énormes quantités de données. La mesure d’une seule protéine produit 250 térabytes. Les DVD, sur lesquels les stocker, formeraient un empilement de la hauteur de la tour de Pise.
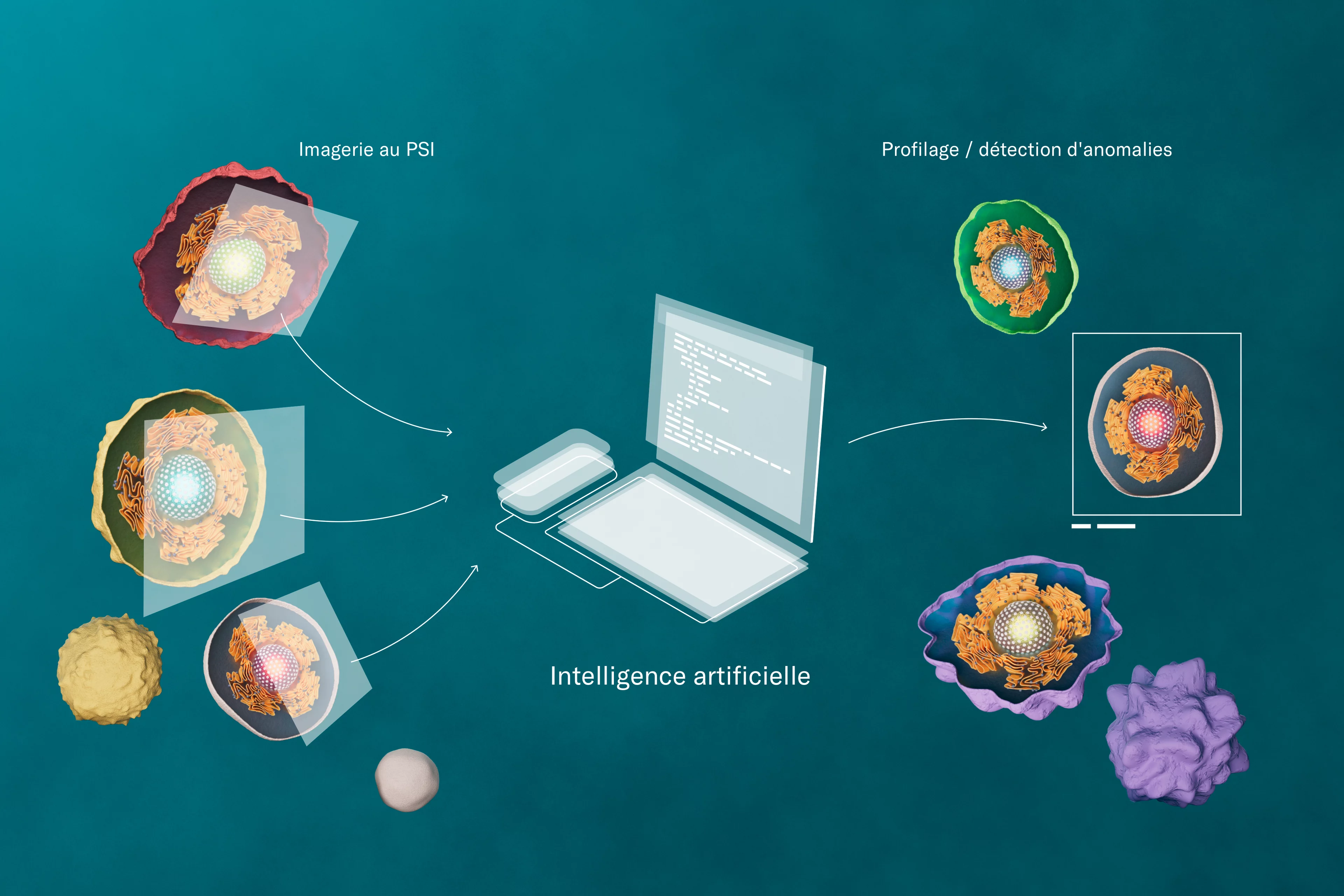
L’étude du cytosquelette nécessite de mesurer toute une série de protéines, de complexes protéiques et d’autres biomolécules; de réaliser des images de leurs structures; de les comparer et d’observer les interactions moléculaires. Pour avancer, tout en gardant une vue d’ensemble, des formes modernes d’analyse des données sont devenues indispensables, de même que le recours à l’intelligence artificielle. G.V. Shivashankar, chef du Laboratoire de biologie à l’échelle nanométrique et professeur de mécano-génomique à l’EPF Zurich, par exemple, utilise ces méthodes dans le cadre de ses recherches.
Il étudie, entre autres, une propriété importante du cytosquelette: sa rigidité. Lorsque l’être humain vieillit, la structure de soutien multifonctionnelle de la cellule perd en flexibilité et sa dynamique ralentit. Ce qui favorise l’action des agents pathogènes, qui peuvent mieux intervenir dans les voies de signalisation et se reproduire plus facilement. «C’est peut-être pourquoi les personnes âgées sont plus susceptibles de tomber gravement malades en cas d’infection par le Covid-19», explique le chercheur.
Le cytosquelette a une influence importante sur la forme du noyau cellulaire et sur la manière dont le matériel génétique y est bien empaqueté. Etendues et mises bout à bout, les chaînes moléculaires d’ADN feraient plus d’un mètre de long, mais elles sont si étroitement et habilement roulées en pelote qu’elles tiennent dans le minuscule noyau de la cellule, d’une taille de dix micromètres seulement. Quand le cytosquelette se rigidifie, cet empaquetage ne fonctionne plus de manière optimale et les différents gènes ne peuvent plus être lus avec la même efficacité en vue de fabriquer les protéines dont le corps a besoin, par exemple, pour le métabolisme et la transmission du signal.
Et, ici, l’imagerie moderne pourrait faire une percée: «Nous connaissons déjà plusieurs centaines de substances actives qui ciblent les voies de signal de la cellule, rappelle G.V. Shivashankar. Mais, pour l’instant, on ignore quelles sont les meilleures combinaisons et les meilleures doses pour contrer la rigidité de la cellule et la transmission de signaux limitée.» C’est ce que son équipe cherche à découvrir, en appliquant des substances actives à des cultures de cellules infectées en boîtes de Petri et en observant ce qui se passe à haute résolution. «Nous devons passer au crible tous les principes actifs connus, souligne le chercheur. Et le PSI possède l’infrastructure nécessaire pour cela. La SLS, notamment, s’y prête idéalement.»
La racine de nombreuses maladies
Cette recherche revêt une importance particulière, notamment parce que l’on part aujourd’hui du principe qu’un empaquetage défectueux du patrimoine génétique dans le noyau cellulaire joue un grand rôle dans le développement du cancer et des maladies neurodégénératives comme Alzheimer. Le laboratoire de G.V. Shivashankar travaille à trouver une méthode qui réalise de manière routinière des images de noyaux cellulaires pour déterminer, sur la base de différentes caractéristiques, la manière dont l’ADN est empaqueté. Celle-ci permettrait de prédire quels sont les gènes qui ne peuvent pas être lus et les maladies qui en résultent. Ce serait beaucoup plus simple et meilleur marché que de séquencer les gènes un à un pour aboutir au même résultat.
Le défi: les caractéristiques à analyser et à comparer sont extrêmement diverses. Sans de puissants ordinateurs et algorithmes, qui confrontent des centaines de caractéristiques avec des milliers d’images, ce serait ingérable. L’intelligence artificielle détermine de manière fiable les fines différences dans la manière dont l’ADN est empaqueté et identifie les liens avec les défaillances de la cellule. L’équipe de G.V. Shivashankar coopère donc avec des spécialistes de l’apprentissage machine, un groupe emmené par Caroline Uhler, professeure au Massachusetts Institute of Technology à Cambridge, aux Etats-Unis. «L’avantage de l’apprentissage machine réside dans le fait d’identifier des caractéristiques inédites, qui resteraient ininterprétables de manière directe pour l’être humain, mais qui, de manière automatique, donnent une forte indication sur la santé ou sur la maladie des cellules», explique la statisticienne.
Des ordinateurs performants indispensables
Les progrès dans l’apprentissage machine ont d’énormes effets dans tous les domaines où les quantités de données explosent. La masse d’informations augmente également parce que les chercheurs et chercheuses souhaitent examiner chaque cellule une à une pour identifier les maladies. «Même les cellules d’un même type pourraient être structurées de manière différente et, de ce fait, se comporter autrement, rappelle G.V. Shivashankar. C’est comme si l’on voulait examiner et comprendre un à un tous les grains de sable sur la plage.» Alimenté de toujours plus d’exemples, l’ordinateur apprend, avec le temps, quelle structure cellulaire entraîne quel comportement. Il identifie des schémas.
Il serait finalement possible, sur la base de l’image à haute résolution d’un noyau cellulaire, sorte de biomarqueur, de tirer des conclusions sur le bon fonctionnement de la cellule, sur les maladies dont le patient est porteur – ou qu’il pourrait développer – et sur le type de traitement le plus prometteur.
Des interventions précoces et ciblées seraient alors envisageables. Dans tous les cas, la méthode faciliterait énormément le diagnostic. «Toutefois, afin d’exploiter l’énorme potentiel de l’apprentissage machine pour la découverte biologique et le diagnostic médical, il reste crucial d’évaluer soigneusement les biomarqueurs cytosquelettiques et nucléaires en environnement clinique», souligne Caroline Uhler.
Par ailleurs, le groupe de G.V. Shivashankar étudie, avec le Centre de protonthérapie du PSI, si des images à haute résolution de cellules sanguines, du cytosquelette et du noyau cellulaire pourraient fournir des indications claires sur l’efficacité du traitement. «Nous comparons des prises de vues réalisées avant, pendant et après le traitement de la personne atteinte d’un cancer et nous vérifions si les changements intervenus présentent une corrélation avec le progrès du traitement», explique G.V. Shivashankar. Il s’agit là encore d’identifier d’éventuelles irrégularités avec rapidité et fiabilité, à partir d’une gigantesque quantité d’images. «Qui travaille aujourd’hui à ce genre de tâches sans recourir à l’apprentissage machine est certain de rater le coche», conclut le chercheur.
Texte: Jan Berndorff
Droit à l'utilisation
Le PSI fournit gratuitement des images et/ou du matériel vidéo pour la couverture médiatique du contenu du texte ci-dessus. L'utilisation de ce matériel à d'autres fins n'est pas autorisée. Cela inclut également le transfert des images et du matériel vidéo dans des bases de données ainsi que la vente par des tiers.