Wissenschaftler des Paul Scherrer Instituts und der ETH Lausanne beantworten eine 50 Jahre alte Frage aus der Zellbiologie
In menschlichen Zellen finden sich stammesgeschichtlich sehr alte Funktionseinheiten, die als Centriolen bezeichnet werden. Sie nehmen eine wichtige Rolle bei der Zellteilung wahr und bilden das Fundament für feinste Oberflächenstrukturen, mit denen Zellen ihre Umwelt wahrnehmen, miteinander kommunizieren oder sich fortbewegen. Während ihre Funktion bereits gut beschrieben ist, sind die Mechanismen, die zur Bildung der Centriolen führen, seit Jahren Gegenstand einer offenen Frage. Im Fokus steht die Architektur der Centriolen, die durch eine mysteriöse Neuner-Symmetrie charakterisiert ist. Ein Forscherteam um Michel Steinmetz vom Paul Scherrer Institut PSI und Pierre Gönczy von der ETH Lausanne hat nun erstmals ein Modell für die Bildung der Centriolen vorgestellt. Die Forschenden konnten zeigen, dass die Neuner-Symmetrie durch die Fähigkeit eines einzelnen Proteins sich selbst zu organisieren zustande kommt. Da Baufehler in den Centriolen verschiedene Krankheiten verursachen, kann ihr Verständnis zu therapeutischen Anwendungen führen. Über ihre Ergebnisse berichten die Forscher in der renommierten Fachzeitschrift Cell.
Centriolen sind zylinderförmige Strukturen aus Proteinfasern, die bereits früh in der Evolution entstanden sind. Sie zählen zu den Gründer-Organellen des eukaryotischen Stamms und kommen bei Einzellern, allen Tieren und Menschen vor. Die Funktionen der Centriolen sind vielfältig: Als Centrosom sind sie an der Organisation des Spindelapparats zur Trennung der Chromosomen bei der Zellteilung beteiligt. Auch spielen sie eine aktive Rolle bei der Organisation des Zellskeletts, dessen Proteinfasern die Zelle stützen und Stofftransporte besorgen. Als Basalkörper schliesslich bilden Centriolen die Bauvorlage und Verankerung für Zellwimpern (Cilien) und Geisseln (Flagellen). Beides sind Ausstülpungen der Zelloberfläche, die sensorische oder motorische Aufgaben übernehmen und in fast allen Zellen des menschlichen Körpers vorkommen. So besorgen Cilien unter anderem die reinigende Wirkung des Flimmerepithels in den Atemwegen, indem sie Schleim und Schwebeteilchen aus der Lunge befördern. Flagellen ihrerseits verleihen den Spermien ihre Beweglichkeit.
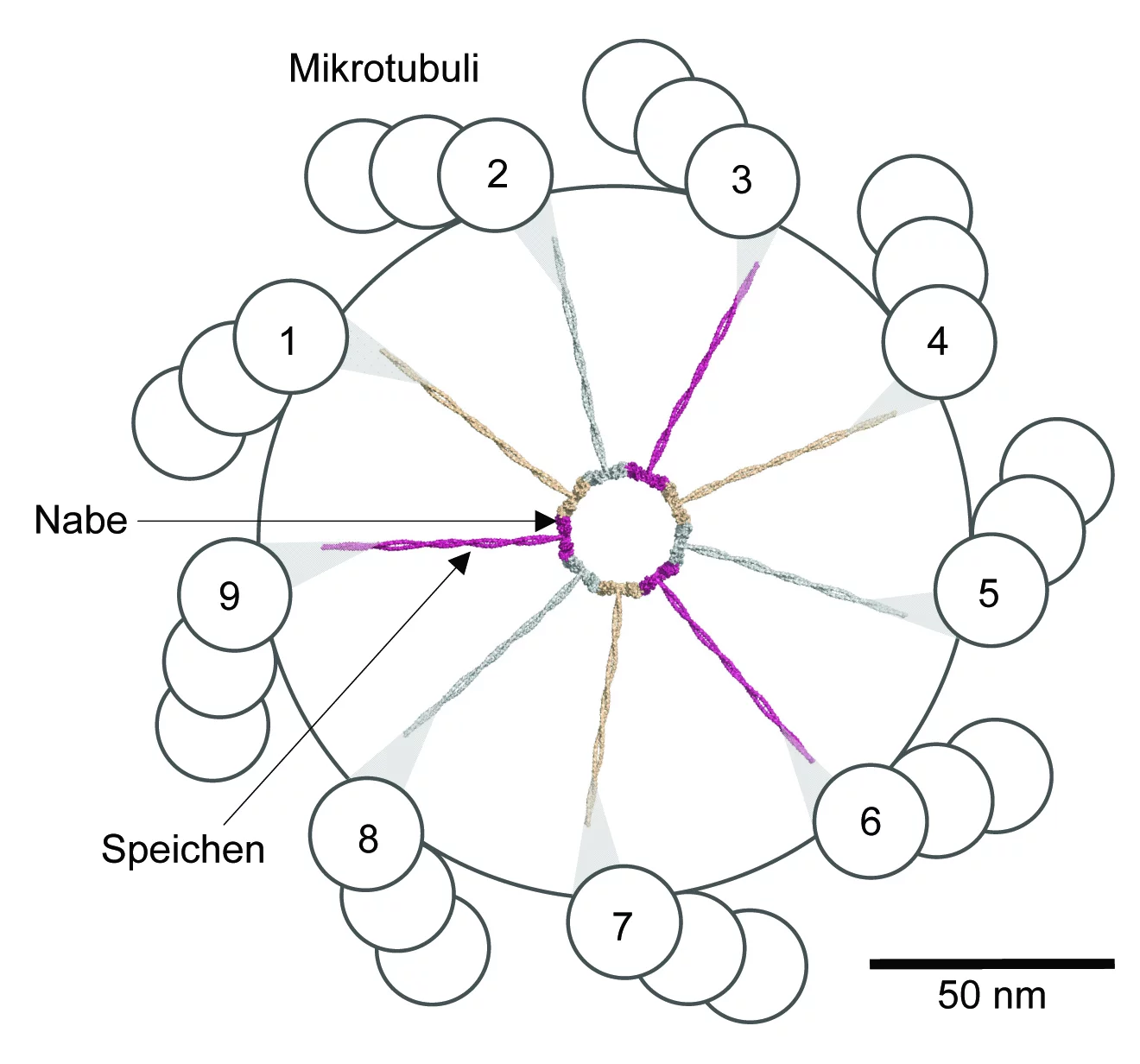
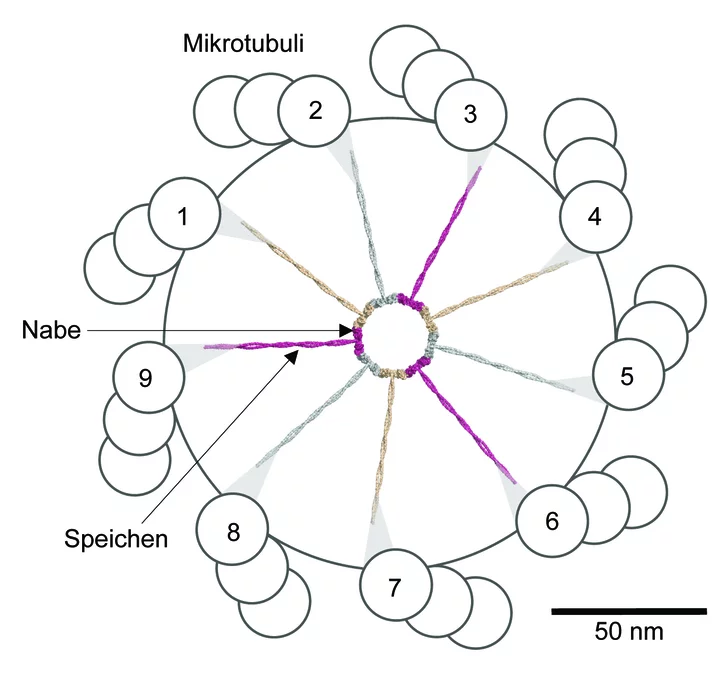
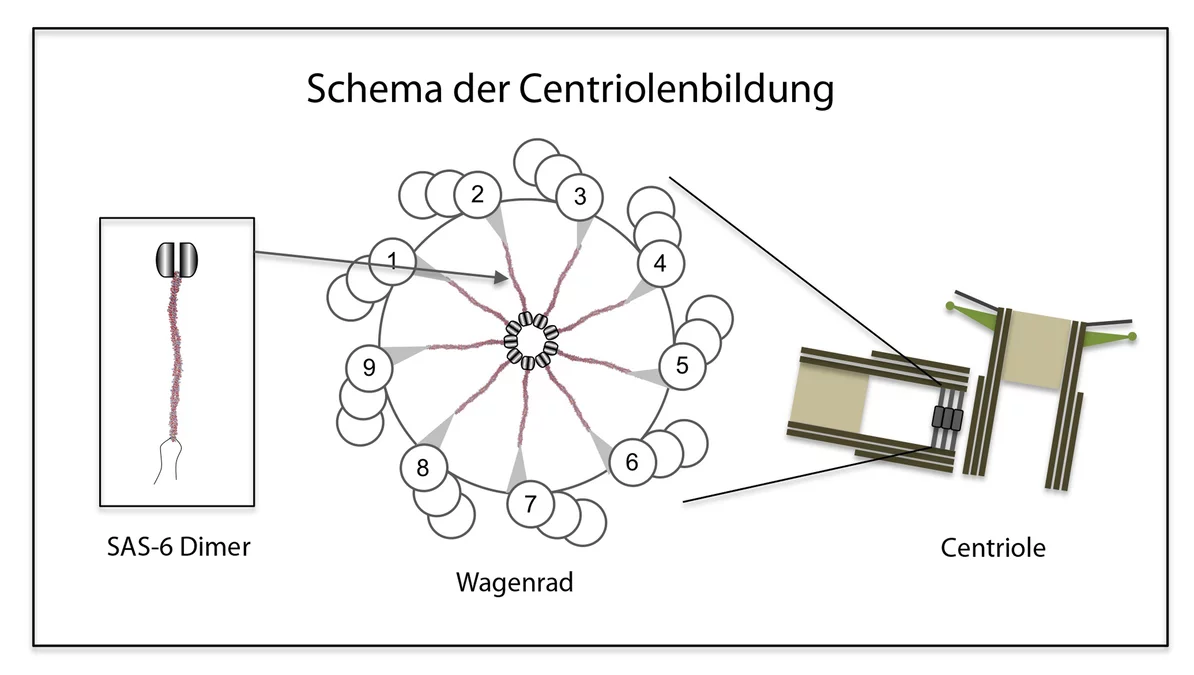
Wagenrad mit neun Speichen
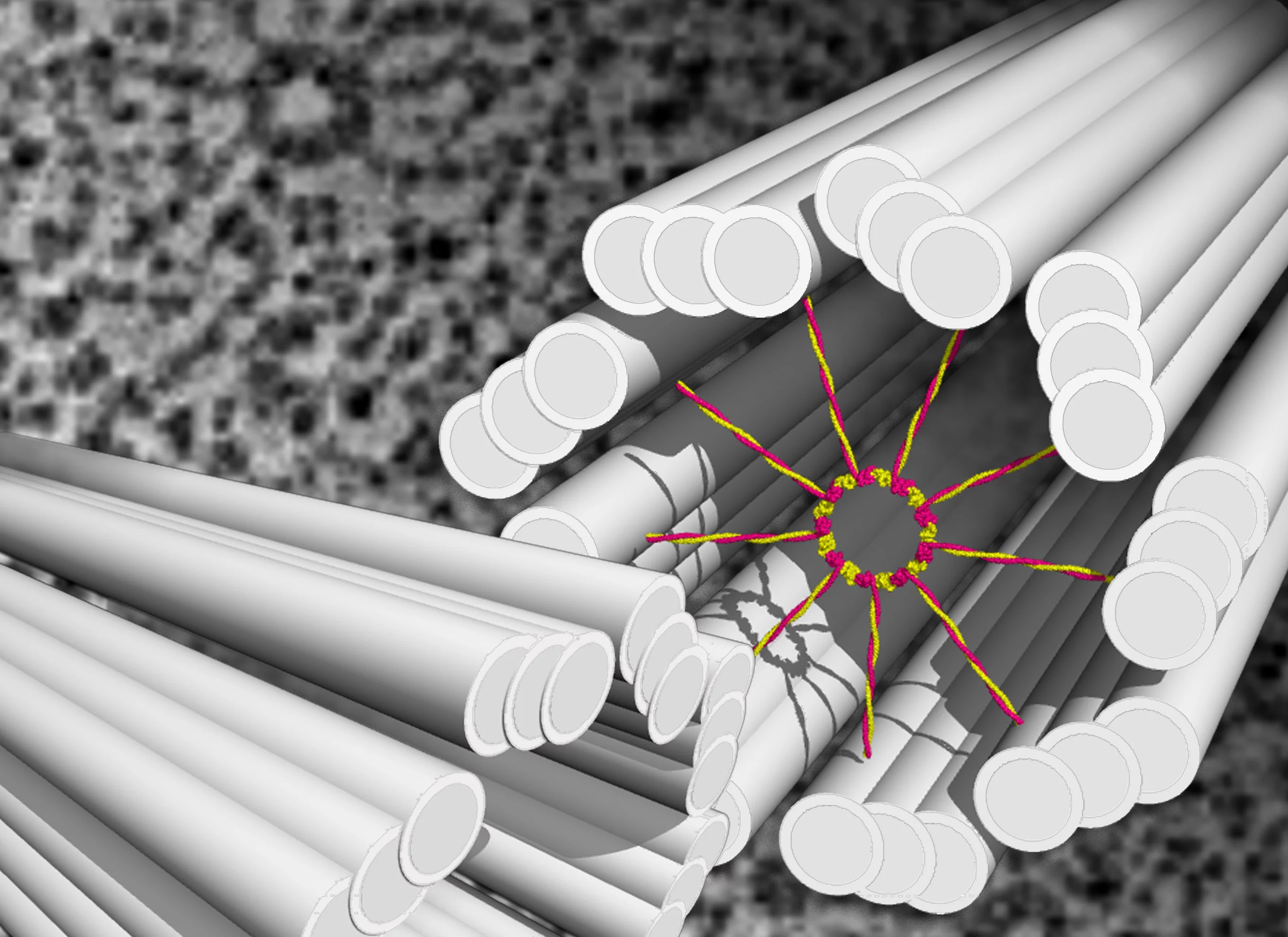
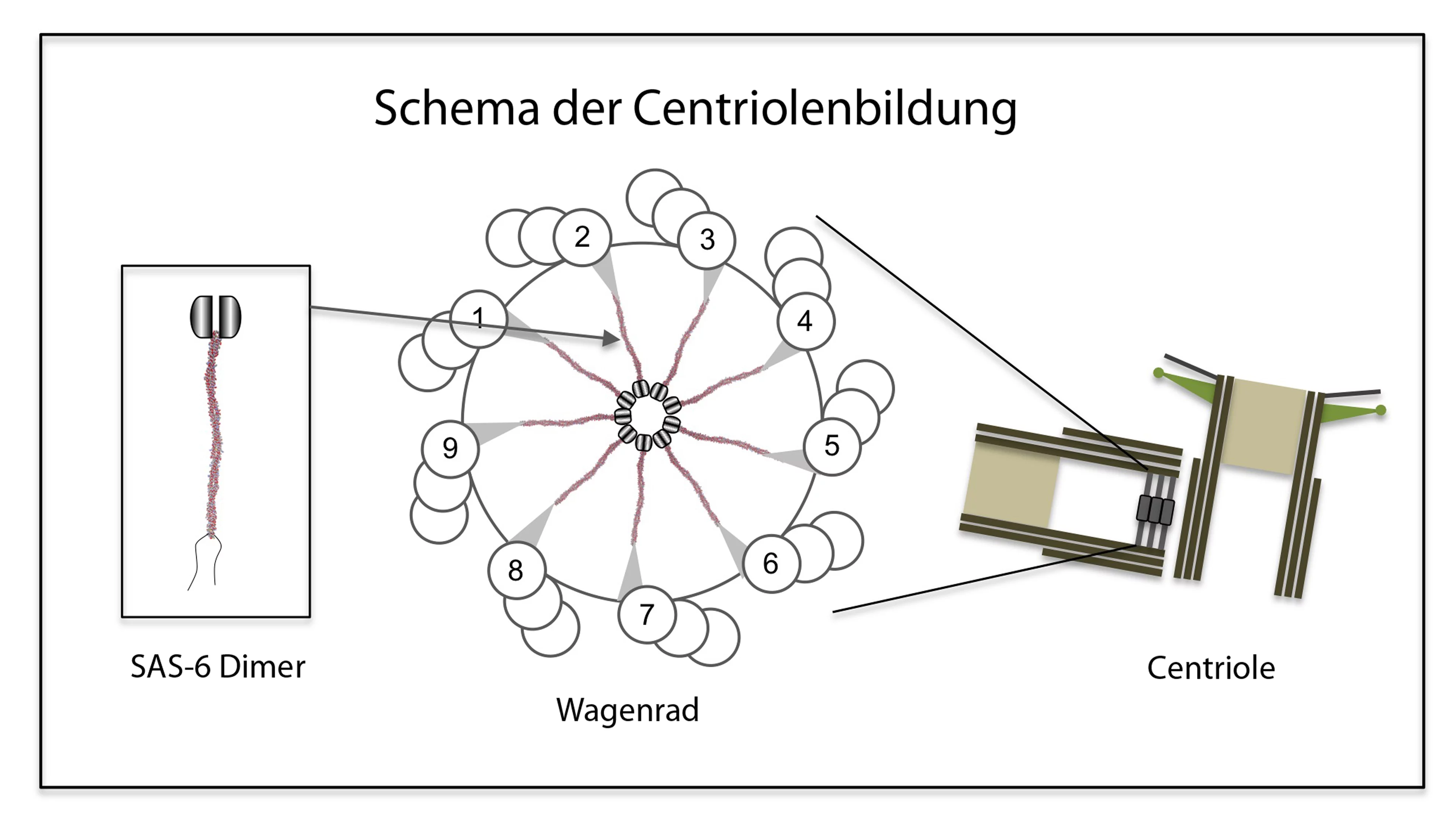
Die Centriolen wurden vor über 50 Jahren entdeckt. Ihr Aufbau ist heute weitgehend bekannt: Sie setzen sich aus Mikrotubuli zusammen – winzigen Röhrchen aus Tubulin, einem Faserprotein. Jeweils neun Dreiergruppen paralleler Mikrotubuli-Röhrchen ordnen sich dabei ringförmig an und bilden einen Zylinder. Biologen sprechen daher von einer Neuner-Symmetrie. Da diese bei allen Arten vorkommt, gilt sie als universell und daher fundamental für die Funktion der Centriole. Auf elektronenmikroskopischen Aufnahmen sieht man, dass Centriolen sich um ein Gebilde herum anordnen, das die Form eines Wagenrads hat und deshalb von den Forschern auch so bezeichnet wird. Das Wagenrad befindet sich im Inneren des Centriols und hat ebenfalls eine Neuner-Symmetrie: Es umfasst eine zentrale Aufhängung, die Nabe
des Rads, von der aus neun Speichen
radialförmig auslaufen. An ihren Enden gehen die Speichen Verbindungen ein mit je einer der neun Mikrotubuli-Dreiergruppen.
Untersuchungen brachten zutage, dass das Wagenrad die massgebende Struktur am Anfang der Centriolenbildung ist, und dass die Symmetrieeigenschaften unabdingbar sind für die Funktion sowohl der Centriolen als auch für deren Abkömmlinge, die Cilien und Flagellen, die diese Eigenschaft übernehmen. Über den Ursprung dieser Neuner-Bausymmetrie bei Centriol und Wagenrad haben Forscher seit der ersten Beschreibung vor 50 Jahren gerätselt. In der jüngeren Vergangenheit wurden zwar einige Proteine bestimmt, die beim Bau der Centriolen eine wichtige Rolle spielen, doch eine schlüssige Erklärung, wie das symmetrische Organell zustande kommt, blieb bis anhin ein Mysterium.
Selbstorganisation als Bauprinzip
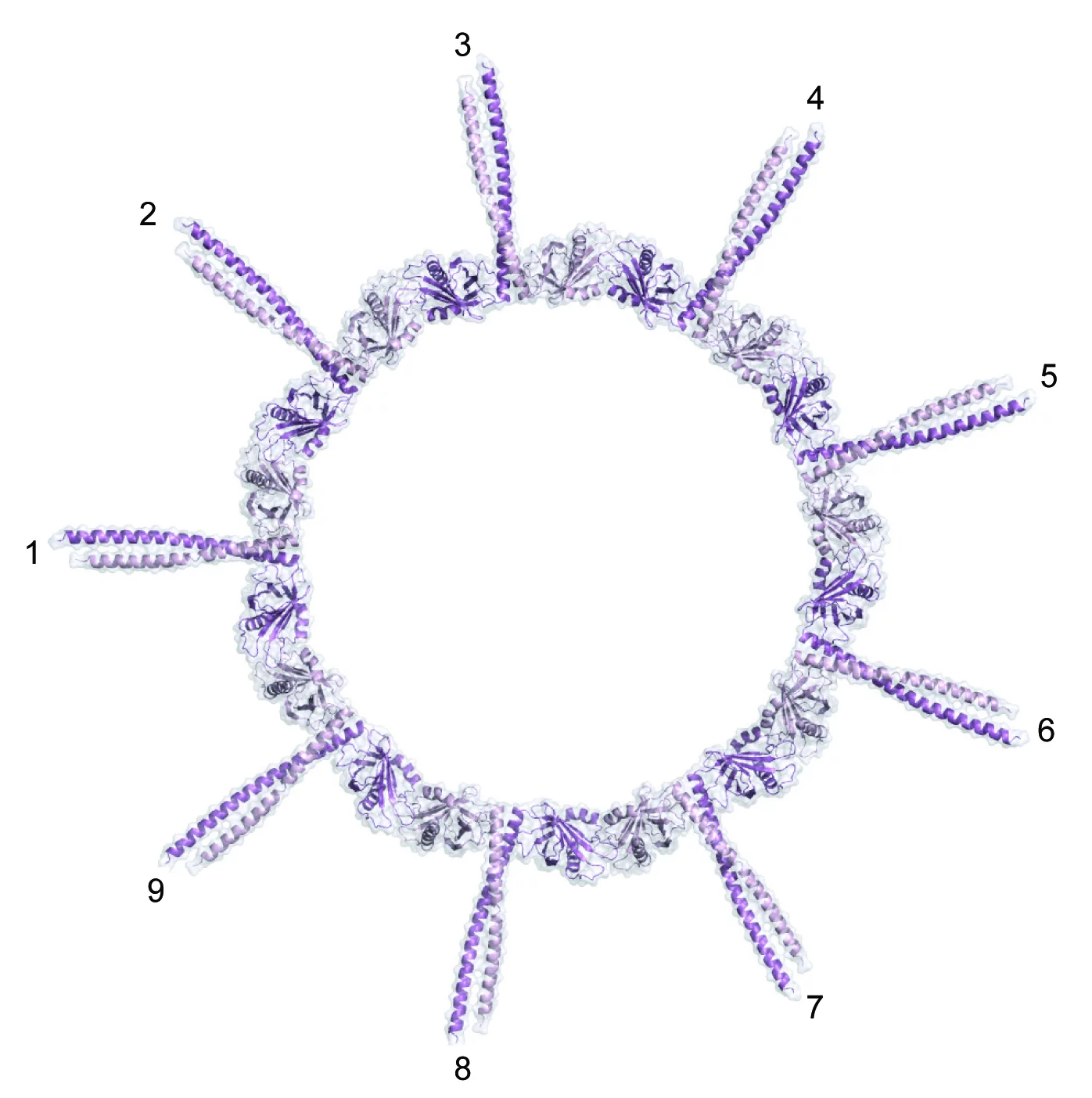
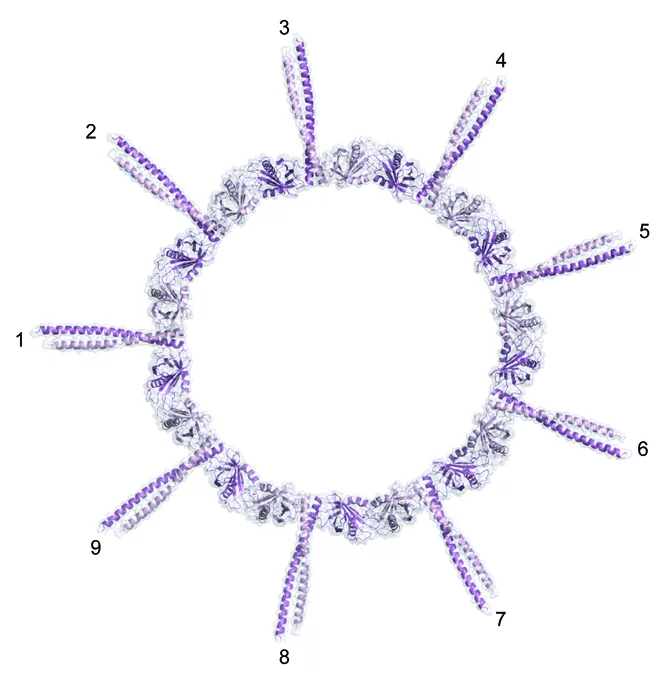
Zur Lösung des Rätsels haben die PSI-Wissenschaftler vom Labor für Biomolekulare Forschung BMR und der Synchrotron Lichtquelle Schweiz SLS zusammen mit Forschern des Schweizer Instituts für Experimentelle Krebsforschung ISREC an der ETH Lausanne nun einen entscheidenden Beitrag geleistet. In ihrer Arbeit konzentrierten sich die Wissenschaftler auf ein Protein mit der Fachbezeichnung SAS-6, von dem man wusste, dass es für die Centriolenbildung essentiell ist. Die Forscher klärten zunächst die räumliche Struktur dieses Bausteins auf und untersuchten dann sein Bindungsverhalten. Dabei fanden sie heraus, dass SAS-6 die Fähigkeit besitzt, mit Seinesgleichen Verbindungen einzugehen: Je zwei SAS-6-Moleküle können sich zu einem sogenannten Dimer
verbinden. Neun Dimere wiederum fügen sich zu einem Oligomer zusammen. Die Forschenden konnten zudem zeigen, dass diese Fähigkeit zur Oligomerisierung ausreicht, um aus dem Zusammenschluss von SAS-6-Proteinen eine dreh-symmetrische Struktur mit neun gleich aussehenden Teilen zu erhalten, welche die gleiche Neuner-Geometrie aufweist wie das Wagenrad im Zentrum des Centriols.
Die Entdeckung überrascht:SAS-6 besitzt die Fähigkeit zur Selbstorganisation. Sie ist in die dreidimensionale Struktur und damit in das Bindungsverhalten des Proteins eingebettet. Selbstorganisation ist zwar ein Grundprinzip lebender Systeme – die Resultate haben uns dennoch verblüfft, da die Natur hier eine erstaunlich einfache Lösung für eine hochkomplexe Struktur hervorgebracht hat
, schwärmt Michel Steinmetz, Leiter der Forschungsgruppe Proteinwechselwirkungen am PSI. In unserem Modell der Centriolenbildung ist SAS-6 das zentrale Symmetrie- und Bauelement. Es bildet selbständig die Wagenräder aus, die ihrerseits als Fundament und Gerüst für das entstehende Centriol dienen
, erklärt der Strukturbiologe.
Ansatzpunkt für neue Therapien
Auch wenn das Wissen um die Symmetrie der Centriolen zunächst Grundlagenforschung ist, eröffnet es dennoch neue Perspektiven für medizinische Anwendungen. Fehlerhafte Centriolen liegen zahlreichen Krankheiten zugrunde: Neben der männlichen Sterilität existieren verschiedenste Cilienkrankheiten, die etwa im Falle der Atemwege mit defekten Flimmerhärchen einhergehen und zu Komplikationen führen. Da die Centriolen an vielen wichtigen Zellvorgängen und Körperfunktionen beteiligt sind – von der Wahrung der Genom-Stabilität bei der Zellteilung bis hin zur Fortbewegung der Spermien – sind sie auch potenzielle Angriffspunkte für neue Wirkstoffe. Insbesondere die Krebstherapie könnte davon profitieren
, erläutert Steinmetz die Bedeutung der Resultate.
Die Forschungsergebnisse wurden durch eine Kombination von strukturbiologischen, biophysikalischen und biochemischen Methoden erreicht. Um die Architektur des SAS-6-Proteins im Detail zu bestimmen, haben die Wissenschaftler das Molekül an der Synchrotron Lichtquelle Schweiz SLS des Paul Scherrer Instituts untersucht. Dabei verwendeten sie das Verfahren der Röntgenkristallographie, bei dem stark fokussiertes Röntgenlicht auf kristallisierte Biomoleküle gerichtet wird. Aus dem Beugungsmuster des Lichts lässt sich daraus in einem aufwändigen Rechenverfahren die Architektur der Proben bestimmen.
Text: Michael Keller
Über das PSI
Das Paul Scherrer Institut entwickelt, baut und betreibt grosse und komplexe Forschungsanlagen und stellt sie der nationalen und internationalen Forschungsgemeinde zur Verfügung. Eigene Forschungsschwerpunkte sind Festkörperforschung und Materialwissenschaften, Elementarteilchenphysik, Biologie und Medizin, Energie- und Umweltforschung. Mit 1400 Mitarbeitenden und einem Jahresbudget von rund 300 Mio. CHF ist es das grösste Forschungsinstitut der Schweiz.
Kontakt / Ansprechpartner
Dr. Michel Steinmetz, Leiter der Forschungsgruppe Proteinwechselwirkungen,Labor für Biomolekulare Forschung, Paul Scherrer Institut,
5232 Villigen PSI, Schweiz
Tel: +41 56 310 47 54, E-Mail: michel.steinmetz@psi.ch
Dr. Pierre Gönczy, Swiss Institute for Experimental Cancer Research ISREC
School of Life Sciences, ETH Lausanne
1015 Lausanne, Schweiz
Tel: +41 21 693 07 11, E-Mail: pierre.gonczy@epfl.ch
Originalveröffentlichung
Structural Basis of the 9-fold Symmetry of CentriolesDaiju Kitagawa, Ioannis Vakonakis, Natacha Olieric, Manuel Hilbert, Debora Keller, Vincent Olieric, Miriam Bortfeld, Michèle C. Erat, Isabelle Flückiger, Pierre Gönczy and Michel O. Steinmetz
Cell 144, 1–12 (4. Februar 2011)
Diese Arbeit wurde durch den Schweizer Nationalfonds gefördert.