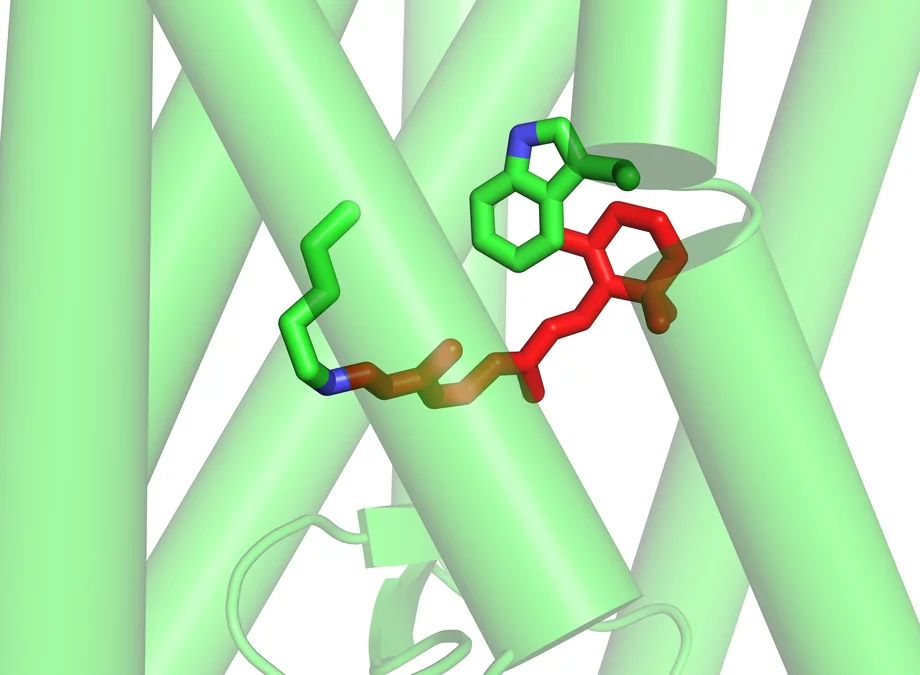
Ce qui se passe dans la rétine au début du processus de la vision.
Lors de la vision, la lumière déclenche un processus chimique en plusieurs étapes, à l’issue duquel une impulsion nerveuse transmet l’impression de lumière en direction du cerveau. L’interaction entre la lumière et la protéine appelée rhodopsine se déroule au début de ce processus. La rhodopsine – qui contient le véritable capteur de lumière –est stimulée par la lumière incidente de manière à modifier sa forme et à activer ainsi le processus de vision.
En collaboration avec des collègues de Grande-Bretagne et des USA, les chercheurs de l’Institut Paul Scherrer ont réussi à déterminer la structure exacte de la molécule de rhodopsine dans cet état d’excitation de courte durée et à fournir un tableau précis de la première étape du processus de la vision. Ce résultat devrait aider à mieux comprendre l’affection oculaire héréditaire appelée rétinite pigmentaire et éventuellement à mettre en évidence des moyens pour la traiter ou ralentir sa progression. De plus, ces nouveaux résultats permettent de fournir les bases permettant de comprendre divers autres processus reposant sur un mécanisme comparable, tels que par exemple la perception des odeurs ou le contrôle de certaines fonction de l’organisme par les hormones. Les chercheurs publient leurs résultats dans la dernière édition de la revue Nature.
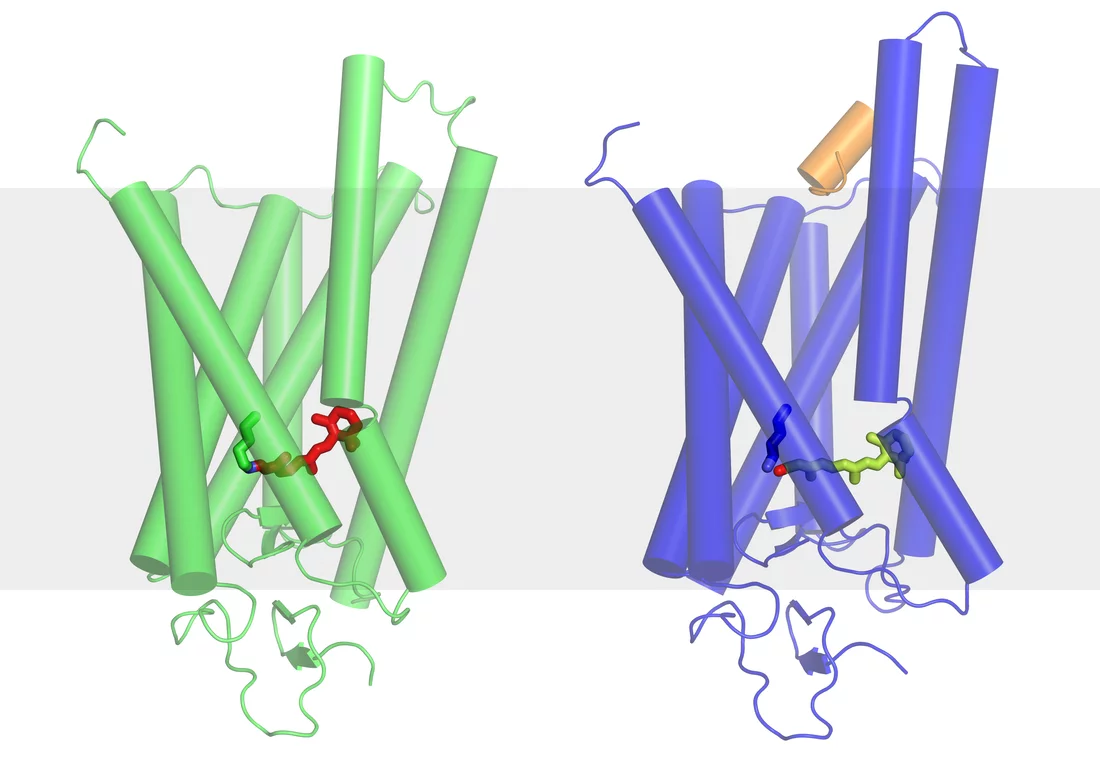
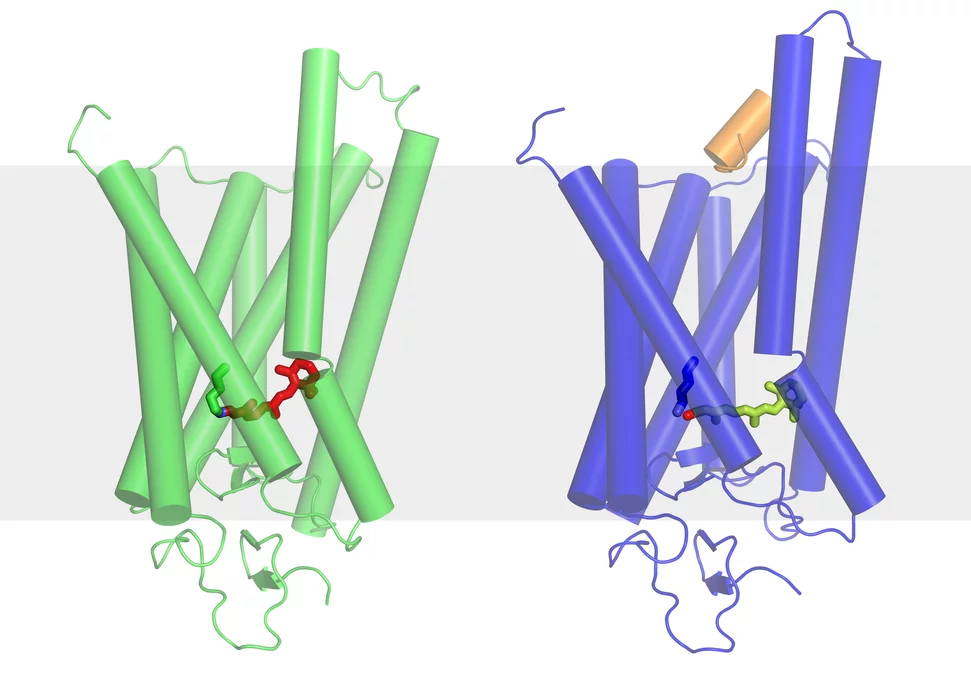
La vision est un processus hautement complexe – un grand nombre de réactions chimiques sont nécessaires avant que ce qui a été vu atteigne notre conscience. Tout au début de ce processus, la lumière touche les cellules visuelles de la rétine de l’œil – les cônes ou les bâtonnets. Les molécules de rhodopsine, les véritables capteurs de lumière, se situent dans les membranes cellulaires des bâtonnets qui sont responsables de la vision dans des conditions de faible luminosité. Ces molécules sont composées de sept segments en forme de bâtonnet, qui vont de l’extérieur jusqu’à l’intérieur de la cellule. Lorsque de la lumière venant de l’extérieur touche la rhodopsine, la disposition des segments en bâtonnets est modifiée, permettant ainsi à une protéine appelée protéine G de s’intercaler. L’arrimage de la protéine G active une cascade de processus à l’issue desquels une impulsion nerveuse est déclenchée.
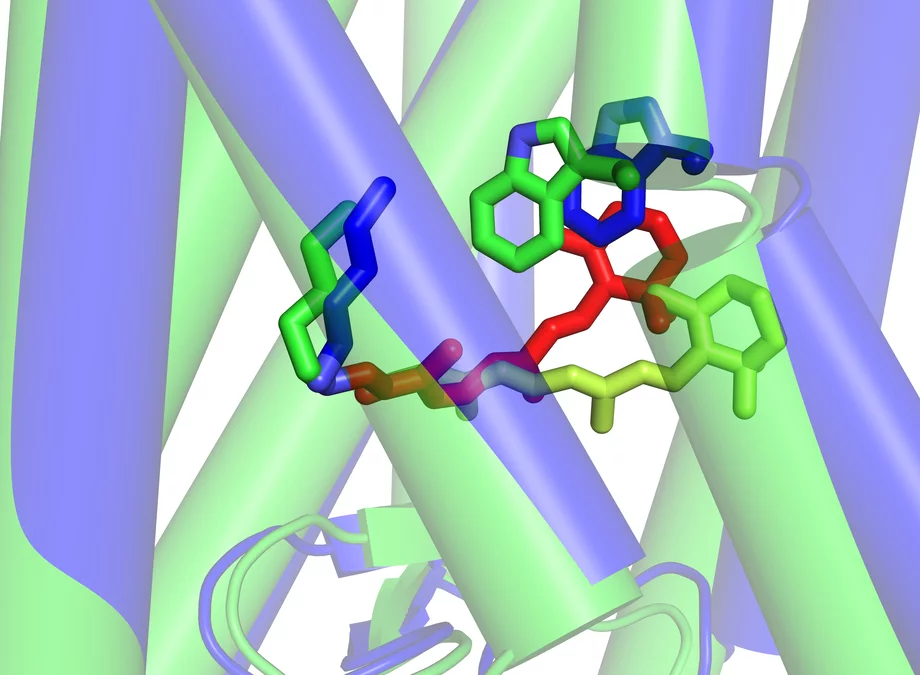
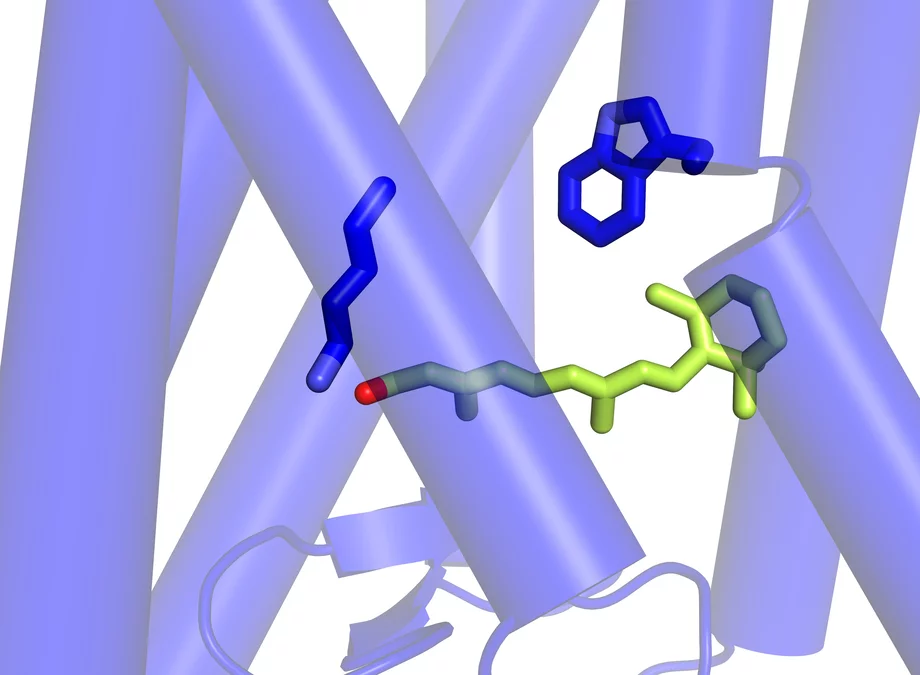
Le véritable pigment photosensible est le rétinal – une forme de vitamine A – qui est inséré entre les sept segments de la rhodopsine sous forme de petite molécule coudée. Dès qu’il est touché par la lumière, il s’étend et écarte des segments de la rhodopsine, libérant ainsi de la place pour la protéine G. Les chercheurs de l’Institut Paul Scherrer ont réussi à déterminer la structure de la rhodopsine activée – c’est-à-dire dans sa forme modifiée par la lumière avec le rétinal allongé. Cet état est en fait de très courte durée, car la rhodopsine doit retrouver le plus rapidement possible l’état dans lequel elle peut être réceptive à la lumière. Les chercheurs du PSI ont trouvé un moyen de modifier la molécule très légèrement de manière à ce qu’elle conserve plus longtemps sa forme activée, ce qui leur a permis de déterminer sa structure. La structure de la forme inactivée de la rhodopsine, telle qu’elle se présente en l’absence de lumière, était déjà connue. La découverte des deux structures permet dorénavant de comprendre précisément comment le processus de la vision commence, au niveau moléculaire, dans l’œil.
Pour les analyses, les molécules correspondantes ont été produites en grande quantité et disposées régulièrement dans une structure cristalline. La rhodopsine est l’une des très rares protéines membranaires de cette classe à pouvoir être cristallisée. Les cristaux ont été examinés au moyen de la lumière synchrotron et les chercheurs peuvent alors déduire la structure des molécules étudiées à partir de la déviation de la lumière observée lorsqu’elle traverse le cristal. Les mesures ont été effectuées à la Source de Lumière Synchrotron Suisse SLS de l’Institut Paul Scherrer et dans deux autres installations comparables.
Comprendre des mécanismes universels de la vie
Le Dr. Jörg Standfuss, responsable du projet de recherche, explique la chose suivante : « L’étude de la rhodopsine nous aide à comprendre une large classe de molécules comparables – on en compte plus de 800 chez l’homme. La plupart d’entre elles ne réagissent pas à la lumière mais à d’autres stimuli et remplissent ainsi les fonctions les plus diverses : dans le cas de l’odorat, elles réagissent à des substances provenant de l’air inspiré. Ou elles servent de récepteurs aux hormones à l’intérieur de l’organisme – par ex. les bêta-récepteurs qui sont co-responsables du contrôle de la tension artérielle au niveau du cœur. » Celles-ci servent de site d’arrimage aux antihypertenseurs appelés bêtabloquants. Globalement, ces molécules présentent un grand intérêt pour la recherche pharmaceutique car, par leur intermédiaire, on peut contrôler ou bloquer de manière très ciblée des processus se déroulant dans l’organisme. Ainsi, les médicaments utilisés en cas de troubles du rythme cardiaque, de migraine ou d’allergies, interagissent avec ces récepteurs. La composition exacte des bêta-récepteurs a fait l’objet d’une autre étude, menée par des chercheurs de l’Institut Paul Scherrer en collaboration avec des collègues de Cambridge, dont les résultats ont également été récemment publiés dans la revue Nature.
Traitements optimisés pour les affections oculaires
« Nous utilisons actuellement aussi notre expérience de l’étude structurale des molécules de rhodopsine modifiées pour l’étude d’une affection oculaire répandue, la rétinite pigmentaire »,explique le Dr. Standfuss. Dans le cas de cette maladie héréditaire, on observe souvent une modification de la rhodopsine dans les bâtonnets de l’œil. Contrairement à ce qui se passe dans un œil sain dans lequel elle est régulièrement renouvelée dans sa totalité, lors d’une rétinite pigmentaire des fragments de « l’ancienne » molécule subsistent et ils détériorent progressivement les cellules visuelles. Au début, cela entraîne une cécité nocturne et à terme, un net rétrécissement du champ visuel. Selon le Dr. Standfuss: « Nous pourrons à l’avenir déterminer avec précision de quelle manière la rhodopsine est modifiée dans le cas de cette maladie et nous pourrons alors aussi étudier comment de petites molécules, qui arrêtent la maladie, sont intégrées dans la rhodopsine. » Grâce à ces connaissances, on pourrait ensuite optimiser de manière ciblée la structure des médicaments notament grâce à l’aide de la bioinformatique.
Recherche internationale
Le Dr. Jörg Standfuss et le professeur Gebhard Schertler, responsable du laboratoire de recherche biomoléculaire de l’Institut Paul Scherrer, ont démarré le projet au MRC Laboratory of Molecular Biology à Cambridge (Angleterre) et l’ont terminé après avoir déménagé au PSI. Cette recherche a été menée en étroite collaboration avec des collègues de la Brandeis University (USA).
Texte: Paul Piwnicki
À propos du PSI
L’Institut Paul Scherrer développe, construit et exploite de grandes installations de recherche complexes et les met à disposition de la communauté nationale et internationale. Les principales recherches de l’Institut sont centrées dans le domaine des corps solides et de la science des matériaux, de la physique des particules, de la biologie et de la médecine, de l’énergie et de l’environnement. Avec 1400 collaborateurs et un budget annuel d’environ 300 millions CHF, le PSI est le plus grand centre de recherche de Suisse.
Contact
Dr. Jörg Standfuss, laboratoire de recherche biomoléculaire, Paul Scherrer Institut, 5232 Villigen PSI, SuisseTéléphone: +41 56 310 2586, e-mail: joerg.standfuss@psi.ch
Professeur Dr. Gebhard Schertler, responsable du laboratoire de recherche biomoléculaire, Paul Scherrer Institut, 5232 Villigen PSI, Suisse
Téléphone: +41 56 310 4265, e-mail: gebhard.schertler@psi.ch
Publication originale
The structural basis of agonist induced activation in constitutively active RhodopsinJörg Standfuss, Patricia C. Edwards, Aaron D’Antona, Maikel Fransen, Guifu Xie, Daniel D. Oprian, Gebhard F. X. Schertler
Nature Advance Online Publication 9 March 2011;
doi: 10.1038/nature09795