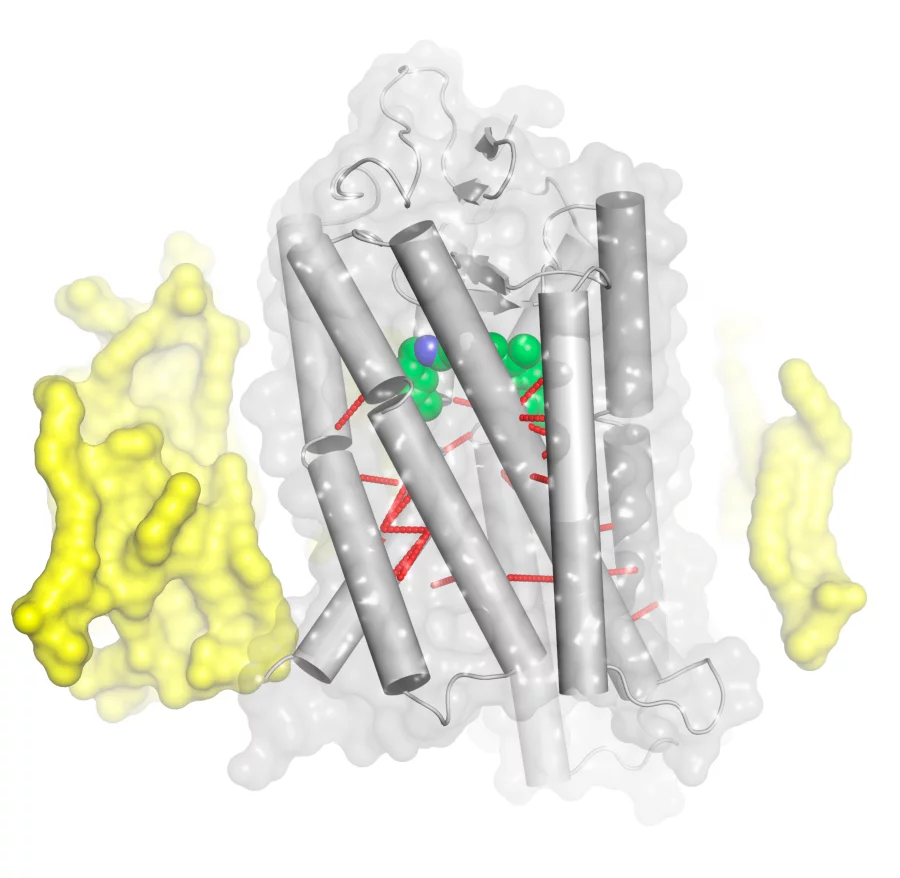
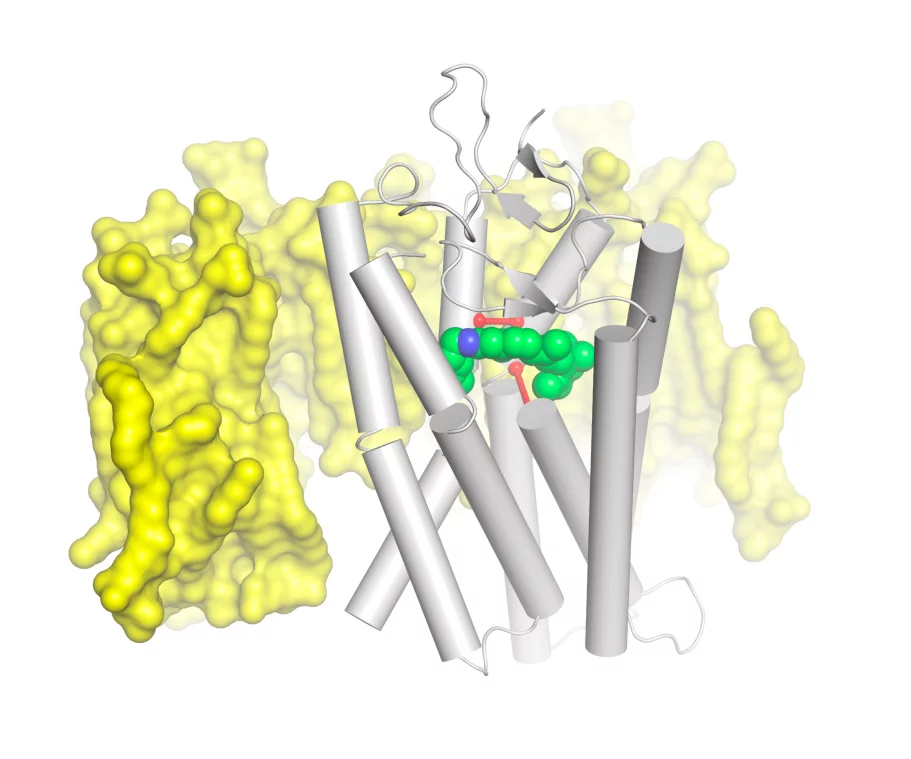
Des chercheurs découvrent certaines particularités structurelles caractéristiques d’une famille de détecteurs, qui traitent les signaux et contrôlent certains processus physiologiques dans le corps humain.
Les cellules du corps humain communiquent sans relâche, afin d’accomplir leurs différentes tâches de manière coordonnée. Elles disposent à cet effet de détecteurs, grâce auxquels elles peuvent recevoir des signaux issus de leur environnement. Les détecteurs situés à la surface des cellules sont appelés récepteurs. Dans notre organisme, de nombreux processus, tels que la vue, l’odorat ou le goût, sont exécutés par une importante famille de récepteurs, appelés récepteurs couplés aux protéines G (RCPG). Cette famille comprend notamment des récepteurs qui contrôlent nos états émotionnels, et jouent un rôle dans la réaction de peur et de stress. Avec leurs collègues britanniques, des chercheurs de l’Institut Paul Scherrer ont à présent analysé et comparé les structures spatiales connues à ce jour de récepteurs RCPG. Ils ont ainsi découvert un réseau stabilisateur de fines contrefiches, présent dans tous les récepteurs, et donc caractéristique de l’architecture de l’ensemble de la famille des RCPG. La connaissance de ces particularités structurelles, conservées au fil de l’évolution, est susceptible de revêtir une utilité considérable pour le développement de nouveaux médicaments. Les chercheurs exposent leurs résultats dans un article de synthèse, paru dans la prestigieuse revue scientifique Nature.
Les récepteurs sont des biomolécules complexes (protéines), localisées au niveau de la membrane cellulaire. Ils sont composés de milliers d’atomes et présentent une structure spatiale définie, qui détermine leur fonction. En tant que centrale de commande de la communication cellulaire, ils identifient les stimuli ou les neurotransmetteurs venus de l’extérieur qui atteignent la cellule, et transmettent les informations relatives à ce signal vers l’intérieur de la cellule. La famille des récepteurs couplés aux protéines G (RCPG) comprend quelque 800 détecteurs apparentés, qui assument les tâches les plus diverses dans l’organisme : ils traitent la lumière, les stimuli olfactifs et gustatifs, relaient l’effet de nombreuses hormones, comme l’adrénaline et l’histamine, et identifient certains neurotransmetteurs, comme la dopamine et la sérotonine. Lorsqu’un neurotransmetteur se lie au RCPG qui lui est destiné, la biomolécule est activée. Elle modifie alors sa forme de manière à ce qu’une protéine G puisse s’arrimer à l’intérieur de la membrane. La liaison de la protéine G au récepteur déclenche une série de processus biochimiques, qui, selon le type de cellule, peuvent entraîner des réponses différentes.
Signature moléculaire de la famille des RCPG
Au cours des 20 dernières années, la détermination structurale dans le domaine des RCPG a fait d’énormes progrès, au point que l’on connaît aujourd’hui la structure détaillée de 17 récepteurs importants de cette famille. En général, les RCPG sont constitués de sept composants moléculaires en forme de petits tuyaux reliés les uns aux autres, qui vont de l’extérieur jusqu’à l’intérieur de la cellule. Au sein de cette formation, entre ces tuyaux moléculaires, des forces électrostatiques subtiles veillent à l’établissement des contacts qui assurent la cohésion de la nanomachine. Des chercheurs de l’Institut Paul Scherrer (PSI) et du MRC Laboratory of Molecular Biology à Cambridge (UK) ont à présent réussi à déterminer, au niveau atomique, les dimensions des structures de récepteurs, et à localiser pour chacun d’eux les positions exactes des contacts entre chaque tuyau moléculaire. Ensuite, les scientifiques ont soumis les données qu’ils ont recueillies à une comparaison systématique, ce qui leur a permis d’identifier 24 contacts communs, qui apparaissent dans toutes les structures de récepteurs analysées, et qui sont chaque fois présents au niveau des mêmes positions-clé au sein de la molécule. « On peut se représenter ces contacts comme un réseau de fines contrefiches, qui s’est conservé au cours de l’évolution et qui caractérise l’architecture de toute la famille des RCPG », explique Xavier Deupi, spécialiste de la biologie structurale au laboratoire de recherche biomoléculaire du PSI. Les chercheurs ont également découvert des similitudes dans les poches de liaison de différents récepteurs RCPG. Ils se sont surtout concentrés sur les contacts entre les récepteurs et leurs ligands liés, c’est-à-dire sur les molécules signalétiques qui s’arriment au fond des poches de liaison. « Les poches de liaison de différents récepteurs se distinguent nettement les unes des autres par la taille et la forme des ligands, poursuit le chercheur. Néanmoins, nous avons pu identifier, au fond de la poche, une sorte de prise universelle. Cette prise comprend quatre emplacements dans la protéine, qui forment toujours quatre contacts vers le ligand, indépendamment de la nature de ce dernier. » Comme la prise universelle est présente dans tous les récepteurs, les scientifiques partent du principe que cette zone de la poche de liaison joue un rôle décisif dans l’activation des récepteurs RCPG.
Analyse comparative de structures de protéines
Pour leurs analyses, les chercheurs ont développé un procédé, qui permet de réduire l’information sur la structure spatiale des protéines au schéma des contacts au sein des molécules. Afin de pouvoir procéder à une comparaison des schémas obtenus, ils ont utilisé la méthode de l’analyse des réseaux, dont les bioinformaticiens se servent d’habitude pour étudier les interactions des réseaux biologiques. « Cette façon de procéder nous permet, pour la première fois, de considérer sans a priori des structures de récepteurs apparentées et de filtrer les similarités, explique Gebhard Schertler, directeur du domaine de recherche Biologie et Chimie au PSI. Nous avons pu ainsi valider la méthode. Parmi les contacts qui ont été mis en évidence, il y en avait, bien entendu, que nous connaissions déjà. Quant aux contacts restants, qui représentent plus de la moitié, nous les avons véritablement découverts, et certains d’entre eux étaient des contacts entre prises universelles et ligands».
Point de départ pour le développement de nouveaux médicaments
Les RCPG sont impliqués dans d’innombrables processus de l’organisme. Ils fonctionnent comme détecteurs de lumière dans nos yeux, rendent possible l’odorat et le goût, contrôlent certaines réactions de peur et de stress, et régulent nos états émotionnels. De fait, cette famille de récepteurs revêt un grand intérêt pour la recherche pharmaceutique. « La connaissance exacte des structures des récepteurs et de leurs caractéristiques structurelles communes contribue d’un côté à une meilleure compréhension de certains processus vitaux fondamentaux, précise Xavier Deupi. De l’autre, nos résultats constituent aussi une base pour le développement assisté par ordinateur de nouveaux principes actifs. Nos résultats peuvent par exemple contribuer à élaborer de meilleurs modèles de RCPG, même pour ceux dont nous ne connaissons pas encore la structure en détail. » Près de la moitié des médicaments aujourd’hui disponibles présentent le mode d’action suivant : ils s’arriment aux RCPG et influencent leur activité. Exemples connus : les beta-bloquants (des antihypertenseurs courants), certains anti-inflammatoires comme les antihistaminiques, différents médicaments psychotropes et certains antimigraineux.
Texte: Michael Keller
A PROPOS DU PSI
L’Institut Paul Scherrer développe, construit et exploite de grandes installations de recherche complexes, qu’il met à disposition de la communauté nationale et internationale de la recherche. Les points forts de la recherche conduite entre ses murs portent sur les domaines suivants : matière et matériaux, santé humaine, énergie et environnement. Avec 1500 collaborateurs et un budget annuel d’environ 300 millions CHF, le PSI est le plus grand institut de recherche de Suisse.
CONTACT / INTERLOCUTUER
Prof Gebhard Schertler, directeur du domaine de recherche Biologie et Chimie
Institut Paul Scherrer, 5232 Villigen PSI, Suisse
Téléphone : +41 56 310 4265 ; mobile : +41 79 543 7838,
e-mail: gebhard.schertler@psi.ch [allemand, anglais]
Xavier Deupi, directeur de groupe de recherche
Institut Paul Scherrer, 5232 Villigen PSI, Suisse
Téléphone : +41 56 310 3337 ; e-mail : xavier.deupi@psi.ch [anglais, espagnol]
PUBLICATION ORIGINALE
Molecular signatures of G-protein-coupled receptors A. J. Venkatakrishnan, Xavier Deupi, Guillaume Lebon, Christopher G. Tate, Gebhard F. Schertler & M. Madan Babu
Nature 494, 185–194 (14 février 2013)
doi: 10.1038/nature11896
LIENS EXTERNES
Laboratoire recherche biomoléculaire
Groupe de recherche de Gebhard Schertler
Groupe de recherche de Xavier Deupi
Laboratoire de Madan Babu à Cambridge