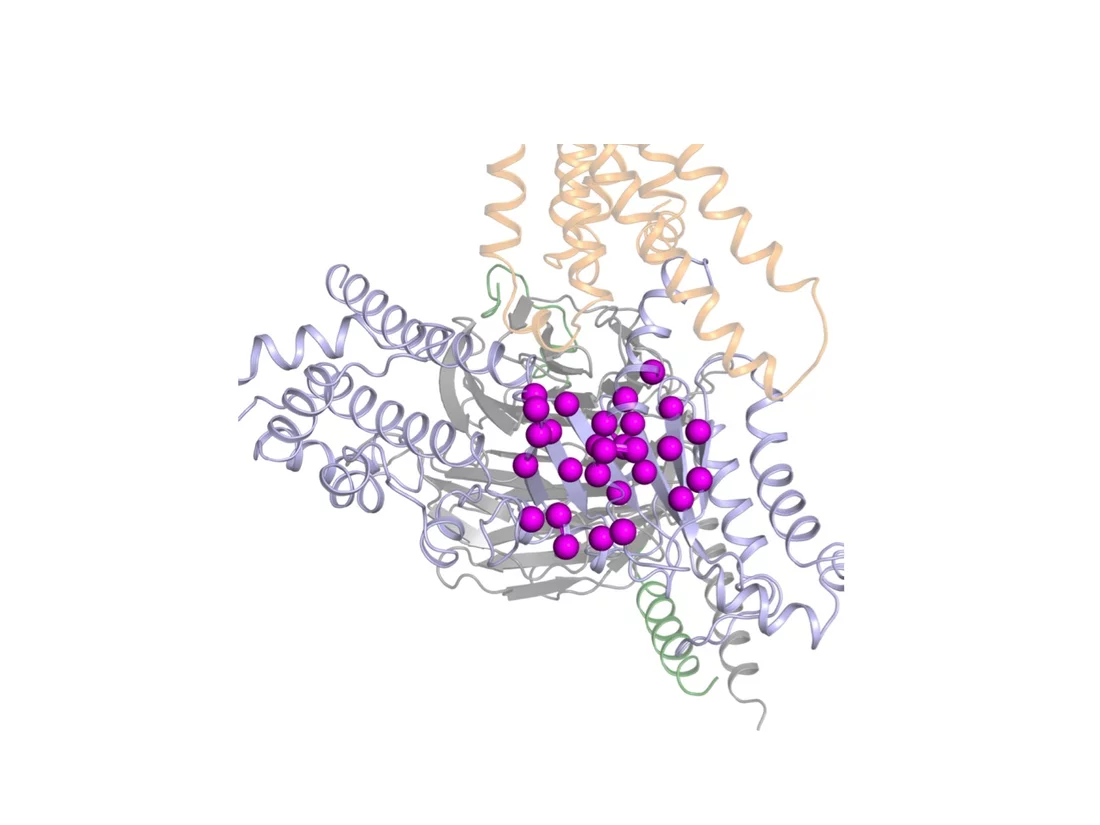
Une nouvelle étude révèle des détails inédits sur la manière dont les cellules des êtres vivants traitent les stimuli externes et internes. Les protéines G sont au centre de cette étude co-financé par le Fonds National Suisse FNS : elles contribuent à transmettre vers l'intérieur de la cellule les stimuli qui atteignent cette dernière depuis l'extérieur. Grâce à une technique développée à l'Institut Paul Scherrer (PSI), les auteurs de cette étude ont découvert quelle est la partie des protéines G qui s'avère décisive pour leur fonctionnement. Ils ont notamment montré que seuls quelques composants de la protéine influencent ce fonctionnement de manière déterminante. D'autres composants, en revanche, peuvent être modifiés sans que ce même fonctionnement ne s'en trouve perturbé. Ces nouveaux éléments font avancer d'un grand pas la compréhension de nombreux processus comme la perception sensorielle et l'action des hormones, mais aussi le développement de nouveaux médicaments. Les résultats de cette étude ont été rapportés par des chercheurs de l'Institut Paul Scherrer (PSI), de l'EPF Zurich, de l'entreprise pharmaceutique Roche et du MRC Laboratory of Molecular Biology (Angleterre) dans la dernière édition du magazine spécialisé Nature Structural and Molecular Biology.
Lorsque nous voyons un objet, voilà ce qu'il se passe : la lumière émise par l'objet atteint notre œil ; les cellules nerveuses transmettent alors un signal à notre cerveau, signal que ce dernier interprète comme l'image d'un objet. L'impulsion pour cette transmission du signal est donnée par une protéine appelée rhodopsine. La rhodopsine est un récepteur couplé à ce qu'on appelle une protéine G. Située dans les cellules de la rétine, elle est activée dès que la lumière atteint l'œil. La rhodopsine fonctionne comme un interrupteur qui, une fois actionné, transmet le signal aux protéines G à l'intérieur de la cellule. Celles-ci renforcent le signal et le transmettent à leur tour plus loin dans la cellule. De nombreuses paires récepteur couplé à une protéine G / protéine G fonctionnent de manière analogue. Par exemple les récepteurs adrénergiques qui sont activés dans les cellules musculaires quand le corps sécrète l'hormone appelée adrénaline en situation de stress. La protéine G à laquelle est couplé le récepteur adrénergique transmet le signal qui aboutit à la tension des muscles. Une équipe, placée sous la responsabilité conjointe de chercheurs de l'Institut Paul Scherrer (PSI) et de l'EPF Zurich, avec la participation du MRC Laboratory of Molecular Biology (Angleterre) et de l'entreprise pharmaceutique Roche, a mis en évidence de nouveaux détails sur la manière dont se déroule l'activation de cette protéine. Ces éléments de connaissances pourraient être transposables à d'autres processus où des protéines similaires sont impliquées dans la transmission du signal, comme l'odorat, le goût et bien d'autres encore et ils pourraient également permettre de développer de nouveaux médicaments ainsi que d'améliorer ceux déjà existant.
Une recherche qui a ses prix Nobel
Des décennies de recherche ont permis aux spécialistes d'en apprendre beaucoup sur l'interaction entre les protéines G et leurs récepteurs (récepteurs couplés aux protéines G ou RCPG). La découverte de ces mêmes récepteurs a été récompensée par le prix Nobel de Médecine en 1994, et l'élucidation de leur mécanisme de couplage aux protéines G par le prix Nobel de Chimie en 2012. Cependant, on ignorait jusqu'à présent les détails du processus d'activation de la protéine G. La nouvelle étude comble cette lacune. Elle montre comment la forme des protéines G change pendant leur activation, et quels sont les composants de la protéine responsables de ces transformations.
Seuls quelques composants donnent le ton
Comme toutes les protéines, les protéines G sont faites de composants que les spécialistes appellent acides aminés. Dans une protéine, ces acides aminés sont reliées les uns aux autres dans un ordre déterminé, suivant un plan de construction précis. Dans le cas de la protéine G étudiée, ces acides aminés sont au nombre de 354. Pour découvrir la manière dont la protéine G en question est activée, les auteurs de l'étude ont remplacé l'un après l'autre chacun de ces 354 acides aminés par d'autres acides aminés. Puis ils ont mesuré l'impact qu'avait cet échange sur l'intensité de l'activation. « L'analyse des mesures montre que seul un petit groupe d'environ 20 acides aminés est impliqué de manière déterminante dans l'activation de la protéine G », explique Dawei Sun, qui a mené les expériences dans le cadre de sa thèse de doctorat au PSI. Effectivement, seul l'échange de ces acides aminés a eu une influence décisive sur l'activation de la protéine G, alors que l'échange des acides aminés restants est resté pratiquement sans conséquences. Cette influence des acides aminés déterminants, les chercheurs ont pu l'établir à partir de certaines modifications intervenues au niveau de la forme d'une portion de la protéine G qui, à l'état désactivé, ressemble à une banderole enroulée (structure en hélice). « Lors de l'échange des acides aminés déterminants, cette structure ne présentait plus les spires habituelles », détaille Dmitry Veprintsev, directeur de recherche de l'étude au Laboratoire de recherche biomoléculaire du PSI. « Nous avons ainsi pu démontrer que pendant l'activation de la protéine G, la structure en banderole disparaissait, du moins provisoirement », ajoute-t-il.
Utile pour près d'un médicament sur trois
L'importance de ces travaux ne se limite pas à une seule protéine. Le mécanisme qui vient d'être découvert est en effet universel. Autrement dit, il n'est pas uniquement à l'œuvre dans une protéine G donnée, celle analysée dans l'étude, mais dans toutes les protéines G. C'est ce que prouvent les calculs informatiques complexes d'une équipe emmenée par Madan Babu, du MRC Laboratory of Molecular Biology, récemment publiés dans la revue Nature. Dmitry Veprintsev souligne que le travail a permis d'identifier les acides aminés déterminants, à la base du mécanisme d'activation d'une protéine G. Gebhard Schertler, directeur du domaine de recherche Biologie et Chimie au PSI explique que ces connaissance font avancer d'un pas décisif le développement de médicaments qui agissent en activant un récepteur RCPG et la protéine G correspondante. Le bénéfice potentiel ne doit pas être sous-estimé : aujourd'hui déjà, environ 30% de tous les médicaments disponibles déploient leur effet de cette façon. Par ailleurs, les conséquences pourraient aller au-delà des protéines G : « A l' avenir, notre méthode pourra aussi être appliquée à d'autres protéines importantes dont on désire comprendre le mécanisme d'action », assure Dmitry Veprintsev.
Texte: Institut Paul Scherrer /Leonid Leiva
À propos du PSI
L'Institut Paul Scherrer PSI développe, construit et exploite des grandes installations de recherche complexes et les met à la disposition de la communauté scientifique nationale et internationale. Les domaines de recherche de l'institut sont centrés sur la matière et les matériaux, l'énergie et l'environnement ainsi que la santé humaine. La formation des générations futures est un souci central du PSI. Pour cette raison, environ un quart de nos collaborateurs sont des postdocs, des doctorants ou des apprentis. Au total, le PSI emploie 1900 personnes, étant ainsi le plus grand institut de recherche de Suisse. Le budget annuel est d'environ CHF 380 millions.
(Mise à jour : Avril 2015)
Informations supplémentaires
Laboratoire de recherche biomoléculaire (en anglais)Biomolecular Research at the Paul Scherrer Institute (PDF, en anglais)
Contact
Dmitry Veprintsev, chef de projet,Laboratoire de recherche biomoléculaire, Institut Paul Scherrer
Téléphone : +41 56 310 5246, E-mail : dmitry.veprintsev@psi.ch
Gregor Cicchetti, Scientific Relations Manager,
Département Biologie et Chimie, Institut Paul Scherrer
Téléphone : +41 56 310 5382, E-mail : gregor.cicchetti@psi.ch
Publication originale
Probing Gαi1 protein activation at single–amino acid resolutionDawei Sun, Tilman Flock, Xavier Deupi, Shoji Maeda, Milos Matkovic, Sandro Mendieta, Daniel Mayer, Roger Dawson, Gebhard F.X. Schertler, M. Madan Babu, Dmitry Veprintsev
Nature Structural & Molecular Biology, 10 août 2015
DOI: 10.1038/nsmb.3070