Des chercheurs de l’Institut Paul Scherrer PSI et de l'Ecole polytechnique fédérale de Lausanne EPFL ont découvert dans une collaboration internationale un secret du cytochrome c, que cette protéine vitale avait bien gardé jusque-là: des mesures aux lasers à rayons X à électrons libres SwissFEL et European XFEL ont mis en évidence que cette protéine pouvait modifier sa structure d’une manière que les scientifiques avaient pourtant exclu pour ce type de biomolécules. Ce nouvel élément de connaissance peut contribuer à une meilleure compréhension de la fonction du cytochrome c dans la production d’énergie de la cellule. L’étude vient de paraître dans la revue spécialisée Proceedings of the National Academy of Sciences of the USA.
Sans cytochrome c, rien ne va plus, ou presque: il existe différentes variantes de cette protéine chez pratiquement tous les êtres vivants et c’est grâce à elle que nous pouvons produire de l’énergie par le biais de la respiration, autrement dit à l’aide d’oxygène. L’atome de fer situé à l’intérieur de la protéine joue un rôle décisif dans ce processus. Il est en mesure de fixer ou de libérer des électrons, et, ainsi, de modifier rapidement son état électronique.
Les scientifiques distinguent deux états: celui où l’atome de fer a deux charges positives, et celui où l’atome de fer a trois charges positives. Le passage rapide entre ces deux états est décisif pour la fonction de la protéine. Le cytochrome c fait office de transporteur d’électrons et contribue ainsi dans les mitochondries à la synthèse de l’ATP, qui fournit l’énergie à la cellule.
On retrouve ce principe dans de nombreuses protéines de la famille des hémoprotéines, comme l’hémoglobine, qui transporte l’oxygène dans le sang, ainsi que la myoglobine, qui fixe l’oxygène dans nos muscles.
Tout dépend de la déformation en dôme
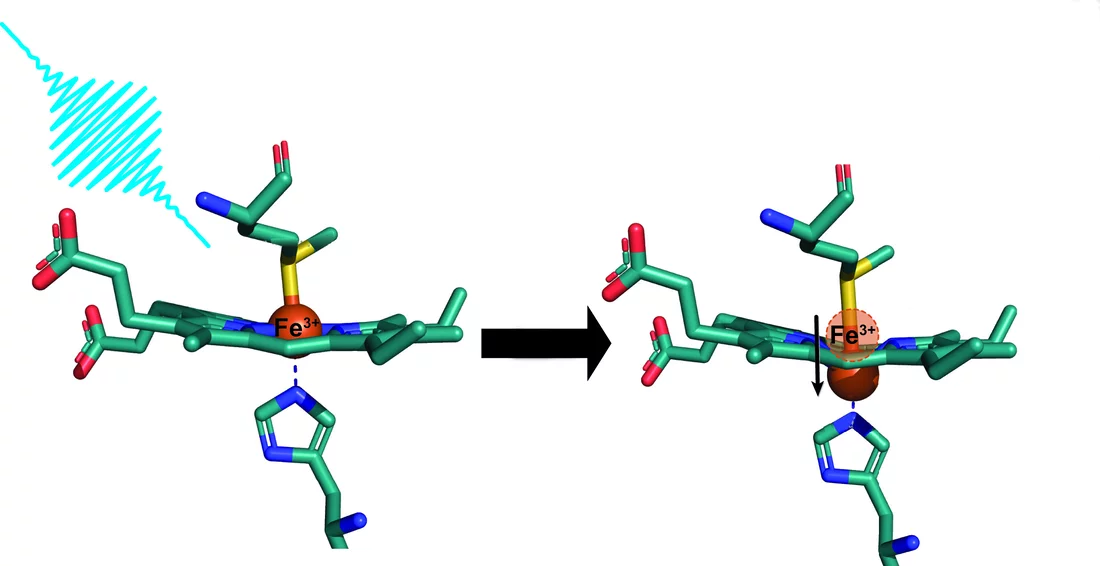
On savait que les hémoprotéines ayant au milieu un atome de fer avec deux charges positives – comme l’hémoglobine et la myoglobine – pouvaient «s’arquer» dans certaines conditions: l’atome de fer sort alors, vers le haut ou vers le bas, du plan de la molécule où il se trouvait. Les scientifiques appellent cet événement déformation en dôme («doming» en anglais). Cette modification de la structure se produit lorsque la molécule est excitée sous quelque forme que ce soit, autrement dit lorsqu’elle reçoit un apport en énergie. En laboratoire, cela peut être réalisé simplement par irradiation avec une impulsion laser.
Dans le cas des protéines ayant un atome de fer avec trois charges positives, comme le cytochrome c, en revanche, le «doming» n’avait encore jamais été observé jusque-là. Les scientifiques partaient du principe que cette modification structurelle ne se produisait pas dans ces molécules. Mais ce postulat était erroné, comme viennent de le découvrir des chercheurs menés par Camila Bacellar du PSI et Majed Chergui de l’EPFL. «Jusqu’ici, nous n’avions pas un aperçu complet de ce qui se passe dans ces protéines, note Camila Bacellar, ancien chercheur post-doctoral à l'EPFL et maintenant scientifique au SwissFEL et première auteure de l’étude. Nous ne connaissions pour ainsi dire que la moitié de l’équation.»
Même les chercheurs ont été surpris
Les chercheurs ont irradié un cytochrome c avec une impulsion de laser ultracourte et mesuré la réaction de la molécule à l’aide d’impulsions de rayons X du SwissFEL. Etonnamment, les données de mesure ont montré que la protéine se déformait en dôme avant de revenir à son état initial. Un résultat qu’ils n’avaient pas prévu. «Nous cherchions en fait tout autre chose et c’est vraiment par hasard que nous l’avons découvert», avoue Camila Bacellar en riant. Pour être bien sûrs, les chercheurs ont effectué d’autres mesures au Laser européen à électrons libres à Hambourg, qui ont confirmé leur hypothèse.
«Les lasers à rayons X à électrons libres comme le SwissFEL et l’European XFEL nous permettent d’examiner de manière très ciblée l’atome de fer au centre de la protéine, relève Christopher Milne, responsable de groupe au Laboratoire de femtochimie du PSI et co-auteur de l’étude. Aucune autre technologie n’aurait permis une telle analyse.»
«Ces nouveaux éléments de connaissance montrent que la déformation en dôme est une caractéristique universelle de toutes les hémoprotéines et qu’elle ne se limite pas à certaines molécules, comme la myoglobine ou l’hémoglobine», ajoute Camila Bacellar. On peut donc supposer que dans le cas du cytochrome c et de protéines apparentées, la déformation en dôme joue un rôle important pour la fonction de la protéine. Mais des analyses ultérieures devront encore montrer lequel exactement.
Texte: Institut Paul Scherrer/Brigitte Osterath
Contact
Dr Christopher Milne
Laboratoire de femtochimie
Institut Paul Scherrer, Forschungsstrasse 111, 5232 Villigen PSI, Suisse
Téléphone: +41 56 310 54 77, e-mail: chris.milne@psi.ch [anglais]
Dr Camila Bacellar
Laboratoire de femtochimie
Institut Paul Scherrer, Forschungsstrasse 111, 5232 Villigen PSI, Suisse
Téléphone: +41 56 310 42 31, e-mail: camila.bacellar@psi.ch [anglais, portugais]
Publication originale
Spin cascade and doming in ferric hemes: Femtosecond X-ray absorption and X-ray emission studies
C. Bacellar, D. Kinschel, G. F. Mancini, R. A. Ingle, J. Rouxel, O. Cannelli, C. Cirelli, G. Knopp, J. Szlachetko, F. A. Lima, S. Menzi, G. Pamfilidis, K. Kubicek, D. Khakhulin, W. Gawelda, A. Rodriguez-Fernandez, M. Biednov, C. Bressler, C. A. Arrell, P. J. M. Johnson, C. J. Milne, M. Chergui
Proceedings of the National Academy of Sciences of the USA, 8 septembre 2020 (en ligne)
DOI: 10.1073/pnas.2009490117
Droit à l'utilisation
Le PSI fournit gratuitement des images et/ou du matériel vidéo pour la couverture médiatique du contenu du texte ci-dessus. L'utilisation de ce matériel à d'autres fins n'est pas autorisée. Cela inclut également le transfert des images et du matériel vidéo dans des bases de données ainsi que la vente par des tiers.