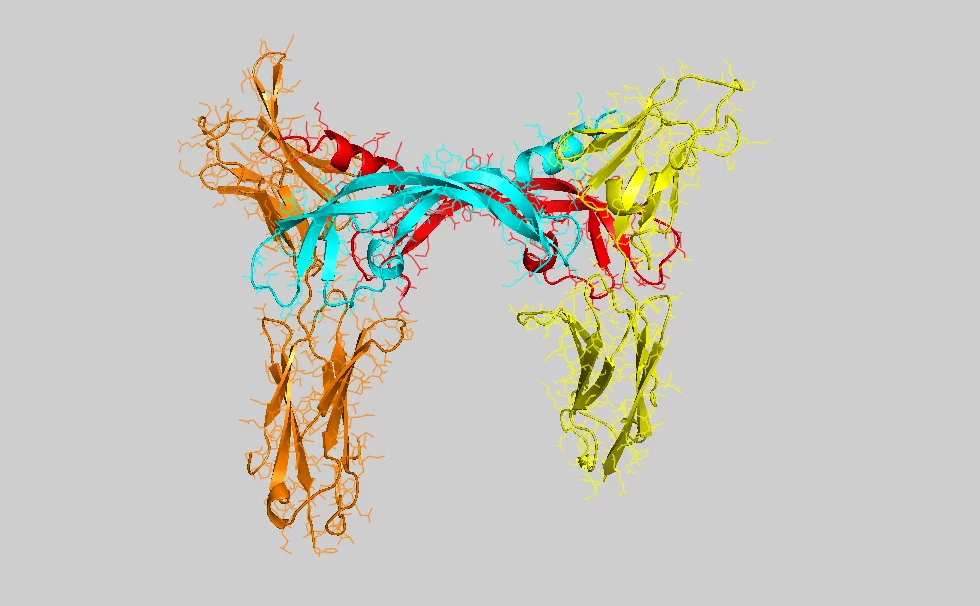
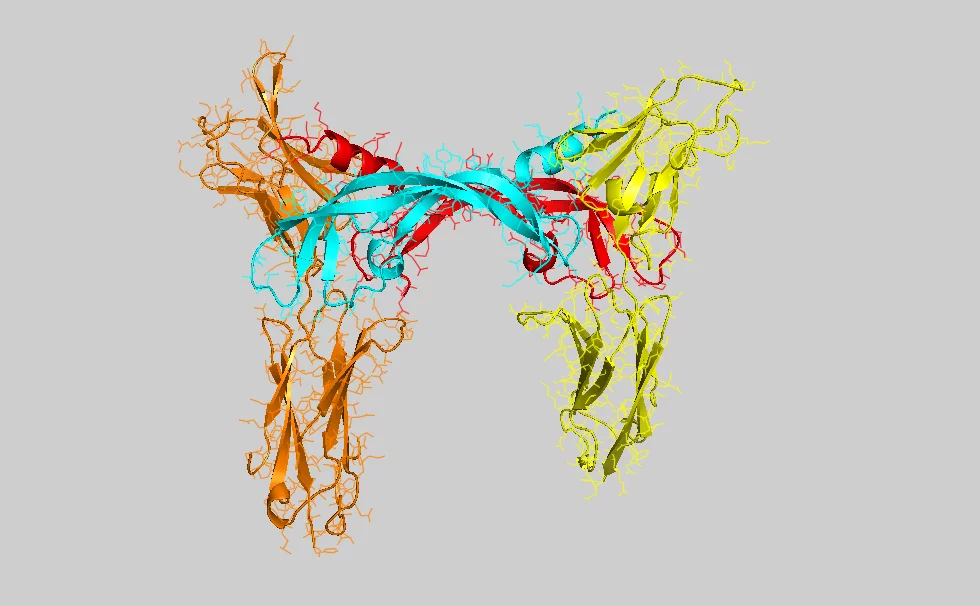
Une équipe de recherche helvético-finlandaise est parvenue à décoder la structure d'un point de liaison essentiel en vue de l'élaboration de médicaments anticancéreux.
Pour se développer, une tumeur cancéreuse doit être irriguée par des vaisseaux sanguins et lymphatiques qui l'approvisionnent en oxygène et en substances nutritives. Ces mêmes vaisseaux assurent également l'élimination des déchets qui se forment dans la cellule. Pour garantir leur approvisionnement, les tumeurs émettent des transmetteurs qui incitent les vaisseaux environnants à se ramifier et à se développer à l'intérieur de la tumeur. Des chercheurs de l'Institut Paul Scherrer et de l'Institut Biomedicum d'Helsinki (Finlande) ont franchi une nouvelle étape vers une meilleure compréhension des processus moléculaires qui interviennent dans la formation de vaisseaux à l'intérieur des tumeurs. Ils ont décodé la structure du point de liaison au niveau duquel une molécule de neurotransmetteur se fixe sur le récepteur correspondant à la surface de la cellule. Cette liaison a pour effet de stimuler la croissance des vaisseaux lymphatiques. Cette découverte peut, à l'avenir, être exploitée pour l'élaboration de nouveaux médicaments conçus pour bloquer ces récepteurs. De tels médicaments peuvent ainsi empêcher la croissance des vaisseaux et interrompre l'approvisionnement de la tumeur. Les résultats paraîtront dans la semaine du 18 janvier dans l'édition en ligne de la revue de l'Académie américaine des sciences (PNAS - Proceedings of the National Academy of Sciences of the United States of America).
Il y a environ 20 ans, Judah Folkman, un médecin américain, avait proposé une thérapie indirecte pour traiter une tumeur. Cette thérapie consistait à bloquer de manière ciblée la croissance des vaisseaux sanguins présents dans la tumeur et, par conséquent, à appauvrir la tumeur et, indirectement, à empêcher sa propagation. Une approche thérapeutique basée sur ce concept a entre-temps été mise au point et appliquée en clinique. L'optimisation de ce procédé requiert une parfaite compréhension des processus moléculaires inhérents à la formation des vaisseaux. Les chercheurs finlandais et suisses ont apporté une contribution décisive dans ce domaine.
Les spécialistes utilisent le sigle VEGF (vascular endothelial growth factor ou facteur de croissance de l'endothélium vasculaire) pour désigner les molécules responsables de la croissance de vaisseaux. La molécule analysée qui stimule la croissance de vaisseaux lymphatiques est appelée VEGF-C. D'un point de vue biochimique, une molécule VEGF est une protéine, c'est-à-dire une biomolécule hautement complexe composée de milliers d'atomes. Cette molécule est active dès qu'elle se lie à l'extrémité d'une autre protéine (le récepteur) présente dans la membrane d'une cellule vivante. La liaison de la molécule VEGF avec le récepteur entraîne une modification de la structure de cette protéine située dans la membrane. Cette modification de la structure, qui prend effet en l'espace de quelques secondes sur le côté intérieur de la membrane de la cellule, déclenche des réactions chimiques qui entraînent une modification des cellules. Dans le cas présent, la cellule est stimulée afin qu'elle se divise et qu'elle contribue à la croissance de nouveaux vaisseaux sanguins et lymphatiques.
Pour que la combinaison entre la molécule de signal et le récepteur fonctionne correctement, chacun de ces deux éléments doit présenter la structure moléculaire unique exacte. En d'autres termes, des milliers d'atomes doivent être correctement positionnés dans l'espace tridimensionnel. Pour déterminer avec précision cette structure, les chercheurs ont examiné les molécules à la Source de Lumière Synchrotron Suisse (SLS) de l'Institut Paul Scherrer. Cet accélérateur de particules produit un rayonnement particulièrement intense qui permet notamment de décoder la structure de protéines complexes. Dans ce but, on a recours à la cristallographie de protéines, procédé dans lequel un très grand nombre de telles molécules est disposé dans une forme régulière (cristallisée) puis est exposé au rayonnement. Une partie de la lumière est déviée dans des directions précises. Sur la base de ces variations de directions, les chercheurs peuvent alors déterminer la structure précise de la protéine.
Le projet mené au sein du PSI, qui a fait l'objet d'une publication dans le PNAS, est soutenu par le PSI, par le Fonds national suisse (FNS) et par la Ligue suisse contre le cancer. Le groupe finlandais était soutenu par la Sigrid Juselius Foundation, la Louis Jeantet Foundation, la Finnish Cancer Research Organizations, et l'Union Européenne dans les projets sur Lymphangiogenomics, Tumor-Host Genomics, and MicroEnviMet.
L'Institut Paul Scherrer
L'Institut Paul Scherrer développe, construit et exploite de grandes installations de recherche complexes et les met à disposition de la communauté nationale et internationale. Les principales recherches de l'Institut sont centrées dans le domaine des corps solides et de la science des matériaux, de la physique des particules, de la biologie et de la médecine, de l'énergie et de l'environnement. Avec 1300 collaborateurs et un budget annuel d'environ 260 millions CHF, le PSI est le plus grand centre de recherche de Suisse.
Informations complémentaires:
Prof. Dr. Kurt Ballmer-Hofer, laboratoire de recherche biomoléculaire, Institut Paul Scherrer, 5232 Villigen PSI, Suissekurt.ballmer@psi.ch, téléphone: +41 56 310 4165 [allemand, anglais]
Dr. Andrea Prota, laboratoire de recherche biomoléculaire, Institut Paul Scherrer, 5232 Villigen PSI, Suisse,
andrea.prota@psi.ch, téléphone: +41 56 310-5160 [allemand, anglais, italien, français]
Publication originale:
Structural determinants of growth factor binding and specificity by VEGF receptor 2Veli-Matti Leppänen, Andrea E. Prota, Michael Jeltsch, Andrey Anisimov, Nisse Kalkkinen, Tomas Strandin, Hilkka Lankinen, Adrian Goldman, Kurt Ballmer-Hofer, and Kari Alitalo
PNAS Early Edition, January 18, 2010