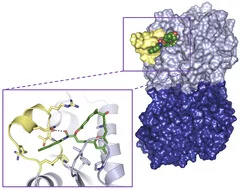
Les informations détaillées sur les structures servent de base au développement de nouveaux médicaments
Les médicaments employés contre le cancer dans le cadre des chimiothérapies empêchent les cellules de se diviser. Les cellules des tumeurs en cours de croissance se divisant plus souvent que les autres, ces cellules tumorales sont particulièrement endommagées par les produits chimiothérapeutiques. Les chercheurs de l'Institut Paul Scherrer et de l'ETH de Zurich ont désormais déterminé le fonctionnement exact d'une certaine classe de ces médicaments. Ces médicaments "gèlent" la motilité des microtubules (de fines fibres présentes au sein de toutes les cellules), empêchant ainsi que les nouveaux chromosomes s'étant formés ne se répartissent parmi les nouvelles cellules. De cette manière, ils contrent la division cellulaire. Les chercheurs ont montré de manière détaillée comment les agents actifs sont logés dans un creux des modules composant les microtubules et comment ils renforcent la cohésion entre ces modules. Il est apparu de manière évidente que des molécules d'agents actifs de structures différentes se lient au même endroit et agissent de la même manière. Les informations obtenues sur ces structures sont si précises qu'il est désormais possible de développer de manière ciblée des médicaments encore mieux adaptés à leurs tâches. Un des agents actifs étudiés, un produit naturel se trouvant dans les éponges de mer, a été recréé synthétiquement à l'ETH de Zurich. Les structures précises ont été déterminées à la Source de Lumière Synchroton Suisse de l'Institut Paul Scherrer. Les résultats viennent d'être publiés dans la pré-version en ligne de la revue Science.
Pour que les ulcères cancéreux puissent croître rapidement, il faut que leurs cellules se divisent rapidement. Les médicaments employés dans le cadre de chimiothérapies empêchent la division des cellules en agissant sur les processus cellulaires impliqués. L'un de ces processus est la séparation des chromosomes, qui portent en eux le matériel génétique. Pendant la division cellulaire, les chromosomes destinés aux deux nouvelles cellules doivent être séparés l'un de l'autre et se répartir sur les nouvelles cellules formées. Les microtubules sont chargés de cette mission. Il s'agit de fibres fines réalisant de nombreuses au sein des cellules et auxquels se rattachent les chromosomes au début du processus de division. Le besoin de dynamicité des microtubules implique que les éléments les composant (des molécules de la protéine tubuline) ne sont reliés entre eux que de manière lâche. Ainsi, de nouvelles unités de tubuline peuvent facilement se fixer aux extrémités des microtubules, ou bien disparaître, ce qui permet à l'extrémité des fibres de se déplacer à travers la cellule. Certains médicaments contre le cancer entravent la dissociation des microtubules, limitant ainsi leur dynamicité et leur motilité au point d'empêcher que les chromosomes ne se séparent les uns des autres. Ainsi, ils empêchent la division cellulaire. Parmi ces médicaments, l'on retrouve le Taxol, présent dans l'écorce de l'if du Pacifique, isolé pour la première fois dans les années 1970 et employé cliniquement depuis le début des années 1990. Mais jusqu'à présent, l'on en ignorait le fonctionnement moléculaire, c'est à dire comment le taxol et les substances agissant de manière similaire empêchaient la décomposition des microtubules, et limitaient, voire stoppaient entièrement leur dynamicité.
Les agents actifs renforcent la liaison
Les chercheurs de l'Institut Paul Scherrer et de l'ETH de Zurich ont désormais déterminé le fonctionnement de deux agents actifs stabilisant, comme le taxol, les microtubules. Le zampanolide, un produit naturel présent dans les éponges des profondeurs marines, ainsi que l'épothilon A, qui peut être extrait des bactéries. Ces deux substances se lient dans un creux à la surface de la tubuline, que l'on nomme "poche de liaison". Elles stabilisent alors un agencement spatial particulier de la protéine dans une zone servant de membre de liaison entre les tubulines voisines. Cela permet de nettement renforcer la cohésion entre chacune des unités de tubuline. Il est intéressant de noter que les deux agents actifs sont issus de sources biologiques totalement différentes, et possèdent des constitutions chimiques également différentes. Mais les deux s'installent dans la "poche de liaison moléculaire" et ont une action similaire.
Une structure précise permet d'améliorer les médicaments
Ces résultats sont importants pour le développement de médicaments améliorés. Car les molécules analysées agissent, certes, mais elles ne s'intègrent pas de manière optimale dans la poche de liaison de la tubuline. "Nous avons pour la première fois des informations si précises sur la constitution du point de liaison qu'il est désormais possible de développer des médicaments dotés d'une structure parfaitement adaptée à ce point de liaison, telle un gant adapté à une main", explique Andrea Prota du Laboratoire de recherche biomoléculaire de l'Institut Paul Scherrer.
Les défis : Fabriquer les molécules d'agents actifs, cristalliser la tubuline
L'un des agents actifs a été synthétisé par un groupe de Karl-Heinz Altmann de l'ETH de Zurich. "La synthèse de la molécule de zampanolide était un véritable défi et a représenté la majeure partie d'une thèse de doctorat. Les produits naturels issus d'organismes marins ne sont généralement disponibles qu'en quantités infimes, et une analyse détaillée de telles substances n'est souvent possible que grâce à leur synthèse en laboratoire. C'est également le cas pour le zampanolide, ajoute Altmann. Les chercheurs ont ensuite déterminé la structure précise des agents actifs et celle de la "poche de liaison" qui les entoure dans la molécule de tubuline au moyen de la Source de Lumière Synchroton Suisse de l'Institut Paul Scherrer, grâce à la cristallographie des protéines. La protéine qui doit être analysée est d'abord produite en grande quantité, puis est intégrée à une structure cristalline régulière (avec une "poche de liaison" pleine ou vide). Ce cristal de protéine est ensuite examiné à la lumière synchrotone de la SLS. En analysant la déflexion de la lumière lorsqu'elle traverse le cristal, l'on peut en déduire la constitution très précise de la protéine. "Les molécules de tubuline ont fortement tendance à se lier ente elles pour former des fibres. Mais c'est précisément ce qu'elles ne doivent pas faire dans le cristal", explique Michel Steinmetz, directeur du groupe de travail sur les interactions protéinées du PSI. "Pour l'expérience, il a été difficile de manipuler la tubuline de manière ciblée au point que ses molécules s'alignent régulièrement et avec une grande précision dans un cristal. Un effort qui nous a coûté plus de 10 ans de travail!"
Texte: Paul Piwnicki
À propos du PSI
L’Institut Paul Scherrer développe, construit et exploite de grandes installations de recherche complexes et les met à disposition de la communauté nationale et internationale. Les principales recherches de l’Institut sont centrées dans le domaine matière et matériaux, energie et environnement, santé. Avec 1500 collaborateurs et un budget annuel d’environ 300 millions CHF, le PSI est le plus grand centre de recherche de Suisse.
Contact
Prof. Dr. Michel Steinmetz, Paul Scherrer Institute,Research Group Dynamic protein interactions, 5232 Villigen PSI, Suisse
Tél: +41 56 310 4754, E-mail: michel.steinmetz@psi.ch [allemand, anglais, français]
Dr. Andrea Prota, Paul Scherrer Institute,
Research Group Dynamic protein interactions, 5232 Villigen PSI, Suisse
Tél: +41 56 310 5160, E-mail: andrea.prota@psi.ch [allemand, italien, anglais]
Prof. Dr. Karl-Heinz Altmann, ETH Zurich
Institute of Pharmaceutical Sciences; 8093 Zürich, Suisse
Tél: +41 44 6337390; E-mail: karl-heinz.altmann@pharma.ethz.ch [allemand, anglais]
Publication originale
Molecular Mechanism of Action of Microtubule-Stabilizing Anticancer AgentsAndrea E. Prota, Katja Bargsten, Didier Zurwerra, Jessica J. Field, José Fernando Díaz, Karl-Heinz Altmann, and Michel O. Steinmetz
Science, 3 January 2013 DOI: 10.1126/science.1230582