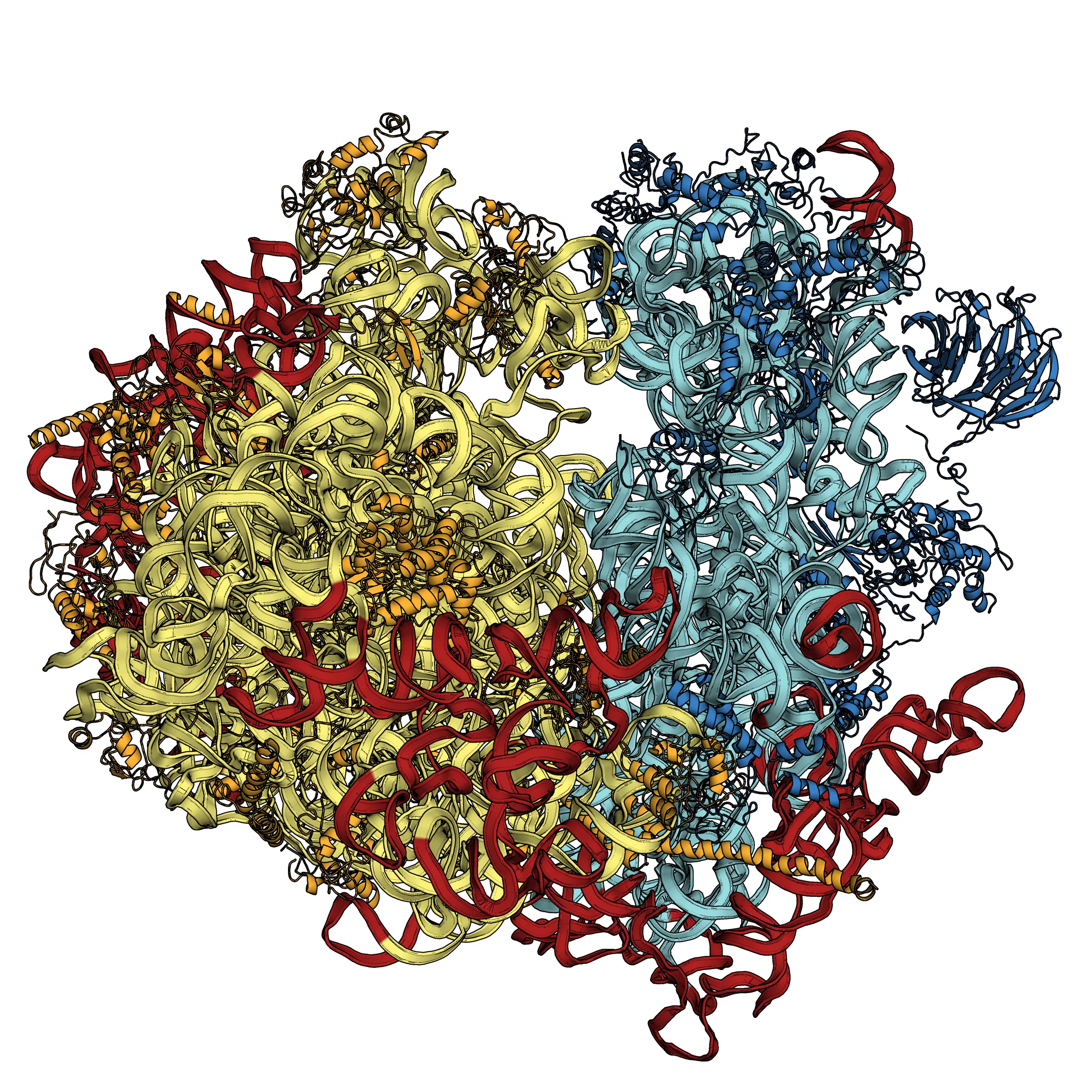
Strukturen eukaryotischer Ribosomen aufgeklärt
Ribosomen sind die Proteinfabriken der lebenden Zellen – und selbst auch hoch komplexe Biomoleküle. Einer französischen Forschungsgruppe am Institut de Génétique et de Biologie Moléculaire et Cellulaire (gemeinsame Einrichtung von CNRS, INSERM und Universität Strassburg) ist es nun gelungen, die Struktur von Ribosomen aufzuklären wie sie in Hefezellen auftreten. Damit wurde erstmals die Struktur von Ribosomen in eukaryotischen Zellen bestimmt, also in komplexen Zellen, die über einen Zellkern verfügen. Das Verständnis von Ribosomenstrukturen trägt nicht nur zu unserem Wissen um biologische Vorgänge bei, sondern kann auch für die Entwicklung neuer Medikamente wichtig sein. Die Ergebnisse sind in der Zeitschrift Science veröffentlicht worden. Ein wesentlicher Teil der Experimente wurde an der Synchrotron Lichtquelle Schweiz SLS des Paul Scherrer Instituts durchgeführt.
In einer lebenden Zelle stellen Ribosomen Proteine her – hochkomplexe Biomoleküle, die für zahllose Aufgaben im Organismus verantwortlich sind. Die Struktur der Proteine ist in der Erbsubstanz DNA niedergelegt und die Aufgabe der Ribosomen ist die Proteine nach diesem Bauplan aufzubauen. In den vergangenen Jahren ist es Forschenden gelungen, die Strukturen von Ribosomen in Bakterien zu entziffern – der Chemie-Nobelpreis 2009 wurde für diese Errungenschaft verliehen. Nun hat eine Forschungsgruppe am Institut de Génétique et de Biologie Moléculaire et Cellulaire in Strassburg, Frankreich, die Struktur von Ribosomen in den komplexeren Hefezellen bestimmt. Im Gegensatz zu Bakterien hat Hefe eukaryotische Zellen, die mit einem Zellkern ausgestattet sind. Deren Ribosomen sind auch viel grösser als die von Bakterien – sie haben eine Masse von 3,3 MDa statt 2,3 MDa. MDa steht dabei für Mega-Dalton, eine in der Molekularbiologie übliche Einheit, die etwa der einmillionfachen Masse eines Wasserstoffatoms entspricht.
Die französischen Forschenden haben die Struktur des Ribosoms mit einer Auflösung von 0,415 Nanometer (Millionstel eines Millimeters) bestimmt. Sie haben auch Bewegungen nachweisen können und zwar nicht nur innerhalb der einzelnen Teile des Ribosoms, sondern auch zwischen ihnen – ein Zeichen für die Bedeutung, die Oszillationen innerhalb des Ribosoms für die Proteinsynthese haben. Ein wesentlicher Teil der Untersuchungen wurde an der Synchrotron Lichtquelle Schweiz SLS des Paul Scherrer Instituts durchgeführt. Hier können Strukturen komplexer Biomoleküle mithilfe von Synchrotronlicht bestimmt werden. Die SLS bietet drei Hochleistungsstrahllinien für derartige Messungen. Einer der Nobelpreisträger von 2009 gehört zu den Nutzern der SLS. Den Nutzern aus anderen Forschungseinrichtungen und der Industrie stehen zusätzliche Angebote zur Verfügung wie etwa die Möglichkeit, die für die Experimente nötigen Kristalle herzustellen.
Das nächste Ziel der Forschenden ist, die Ribosomenstruktur weiterer Organismen zu bestimmen, aber auch die Auflösung der schon erforschten Ribosomen zu verbessern, sodass ein vollständiges Bild der dreidimensionalen Struktur – Atom für Atom – verfügbar wird. Und man kann davon ausgehen, dass sich die Forschenden auch in diesem Fall dafür entscheiden werden, einen Teil ihrer Experimente an der SLS durchzuführen.
Eine genaue Kenntnis der Ribosomenstruktur ist nicht nur ein Beitrag zu unserem Verständnis fundamentaler Lebensvorgänge, sondern kann auch Grundlage für die Entwicklung neuer Medikamente sein. So beruht die Funktionsweise mancher Antibiotika darauf, dass sie die Proteinsynthese in den Bakterienribosomen blockieren. So könnte die genaue Kenntnis der Struktur von Ribosomen in eukaryotischen Zellen helfen, Mittel zu entwickeln gegen Krankheiten, die von Protozoen (wie Malaria, Toxoplasmose, Schlafkrankheit), Pilzen, Viren oder Bakterien ausgelöst werden.
Der Text beruht auf einer Medienmitteilung, die vom CNRS veröffentlicht worden ist.
Über das IGBMC
Das Institut de Génétique et de Biologie Moléculaire et Cellulaire ist eine gemeinsame Forschungseinheit des Centre national de la recherche scientifique (CNRS), des Institut national de la santé et de la recherche médicale (Inserm) und der Universität Strassburg. Als eines der führenden Zentren für biomedizinische Forschung in Europa, widmet es sich der Untersuchung des Genoms höherer Eukaryoten und der Kontrolle der Genexpression sowie der Analyse der Funktion von Genen und Proteinen. Dieses Wissen wird auch für die Untersuchung menschlicher Erkrankungen genutzt.
Über das PSI
Das Paul Scherrer Institut entwickelt, baut und betreibt grosse und komplexe Forschungsanlagen und stellt sie der nationalen und internationalen Forschungsgemeinde zur Verfügung. Eigene Forschungsschwerpunkte sind Festkörperforschung und Materialwissenschaften, Elementarteilchenphysik, Biologie und Medizin, Energie- und Umweltforschung. Mit 1400 Mitarbeitenden und einem Jahresbudget von rund 300 Mio. CHF ist es das grösste Forschungsinstitut der Schweiz.
Kontakt / Ansprechpartner
Dr. Marat Yusupov, Institut de Genetique et de Biologie Moleculaire et Cellulaire, B.P. 10142, 67404 ILLKIRCH CEDEX, Frankreich,
Telefon: + 33 3 88 65 33 01, E-Mail: marat@igbmc.u-strasbg.fr
Dr. Marcus Müller, Labor für Makromoleküle und Bioimaging, Paul Scherrer Institut, 5232 Villigen PSI, Schweiz,
Telefon: +41 56 310 5437, E-Mail: marcus.mueller@psi.ch
Originalveröffentlichung
Crystal Structure of the Eukaryotic Ribosome
Adam Ben-Shem, Lasse Jenner, Gulnara Yusupova and Marat Yusupov,
Science 330, pp. 1203-1209 (26 November 2010)
DOI: 10.1126/science.1194294
Weitere Informationen zur Proteinstrukturanalyse am Paul Scherrer Institut
Études relatives à la structure des protéines
Recherche avec la lumière synchrotron
Bildmaterial
Mit Klick auf das Download-Icon können Sie die hoch aufgelöste Version herunterladen.