Sur les photos prises de nuit depuis l’espace, le flot lumineux des éclairages permet d’identifier facilement les grandes métropoles de la planète. Mais il faut un œil exercé pour réussir à apercevoir sur ces images satellite, à part New York ou Tokyo, les sites de certains puits de pétrole. La lumière qui les signale provient surtout de la combustion de méthane. Le gaspillage d’une ressource naturelle aussi précieuse a des consequences négatives d’un point de vue économique ansi que pour l’environnement. Des scientifiques de l’Institut Paul Scherrer PSI sont à la recherche d’une solution : la transformation du méthane en méthanol.
Le méthane est souvent présent dans les gisements et s’échappe lors de l’extraction du pétrole en raison de sa faible densité – tout comme le dioxyde de carbone s’échappe avec un sifflement d’une bouteille de boisson gazéifiée lorsqu’on la débouche. Aux prix actuels du marché, la transformation, le stockage et le transport du méthane seraient trop coûteux. Le gaz est directement brûlé au moment de l’extraction du pétrole – ce qui produit du CO2 –, ou simplement rejeté dans l’atmosphère. Selon les statistiques de la Banque mondiale, ces pratiques, connues sous le nom de « flaring » ou de « venting », sont à l’origine de 140 milliards de mètres cube de méthane relâchés dans l’atmosphère de notre planète, en 2011. Cela correspond à 30% de la consommation annuelle de méthane en Europe, et à 75% des exportations russes de méthane. D’un point de vue économique, les proportions du gaspillage d’une ressource naturelle aussi précieuse sont énormes. Mais les conséquences négatives sont aussi écologiques, avec une détérioration massive de la qualité de l’air sur place, et une contribution considérable au changement climatique quand le méthane s’échappe directement dans l’atmosphère, puisqu’il s’agit d’un gaz à effet de serre beaucoup plus puissant que le dioxyde de carbone.
L’avantage du liquide
Jeroen A. van Bokhoven, directeur du Laboratoire de catalyse et de chimie durable à l’Institut Paul Scherrer (PSI), rêve d’une solution qui résoudrait le problème de l’atteinte à l’environnement et du gaspillage économique : la fabrication de méthanol à partir du méthane, directement à la source, qui permettrait de transformer le gaz volatile en une ressource énergétique facile à manier. Le stockage et le transport du méthanol jusqu’à l’usager seraient en effet économiquement et techniquement faisables.
Le méthanol a plusieurs avantages par rapport au méthane. D’un côté, il est disponible à l’état liquide à température ambiante et à pression atmosphérique. De l’autre, il est plus réactif que le méthane, en raison de sa structure moléculaire, ce qui en fait un meilleur produit de départ pour la fabrication de carburants et d’autres produits chimiques utiles. Mais jusqu’à présent, les chimistes ont toujours mordu la poussière dans leurs efforts pour mettre au point une production efficace de méthanol à partir du méthane. Les méthodes conventionnelles sont coûteuses et donc inintéressantes d'un point de vue économique.
La première étape du procédé conventionnel de transformation du méthane consiste en un reformage du gaz à la vapeur. De la vapeur d’eau est mélangée au méthane, à une température d’au moins 700º C. Ce processus est très énergivore et donne un mélange de monoxyde de carbone et d’hydrogène, que l’on appelle gaz de synthèse ou « syngas ». Le syngas peut être ensuite transformé en méthanol par le biais d’autres réactions chimiques effectuées sous haute pression.
Une conversion plus directe et moins énergivore du méthane en méthanol serait souhaitable, mais elle représente un casse-tête pour des raisons fondamentales. De par sa structure moléculaire symétrique, et la force de la liaison entre son unique atome de carbone et les atomes d’hydrogène qui l’entourent, le méthane est très stable. En d’autres termes, il est difficile de le transformer chimiquement. Cette difficulté peut être contournée par l’utilisation de catalyseurs – des substances qui favorisent une réaction chimique et peuvent l’accélérer sans être consommées. Mais la quête du bon catalyseur pour la production de méthane est restée infructueuse, en dépit de plusieurs décennies d’efforts intensifs.
L’obstacle de la thermodynamique
Fabriquer du méthanol par transformation du méthane est en effet « contre nature ». Ou, en termes techniques : les lois de la thermodynamique, qui gouvernent la transformation des substances dans le sens de la minimisation de la consommation d’énergie, favorisent plutôt ce qu’on appelle une oxydation complète du méthane, qui finit par produire du dioxyde de carbone. Pour obtenir du méthanol, il faudrait trouver un moyen de stopper le processus d’oxydation au bon moment. Les chimistes recourent à cet effet à un catalyseur sélectif, c’est-à-dire à une substance dont la réaction permet de surmonter l’obstacle vers la production de méthanol, mais qui empêche que le processus se poursuive jusqu’au CO2.
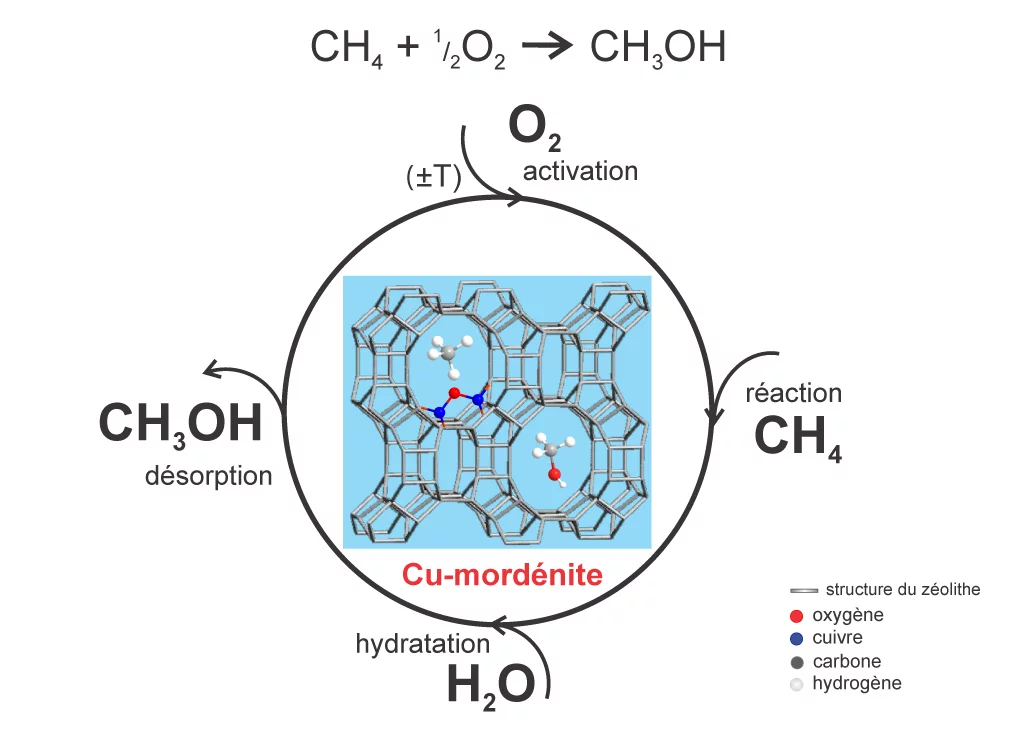
Il y a quelques années seulement, des chercheurs ont réussi une transformation catalytique du méthane en méthanol. Le catalyseur qu’ils ont utilisé est une zéolithe dopée au cuivre, appelée mordénite – un minéral naturel, mais synthétisable aussi à partir d’aluminium, de silicium et d’oxygène. Une fois placés dans les pores de la structure cristalline, les atomes de métal fonctionnent comme des centres catalytiques sélectifs, particulièrement efficaces.
Dans le cadre de ces premiers essais avec la mordénite, l’obtention de méthanol à partir du méthane a été compliquée par le fait que le méthanol produit s’est retrouvé fortement adsorbé à la surface de la zéolithe dopée au cuivre. Il a fallu enlever le catalyseur du réacteur et recourir à un solvant pour séparer le méthanol, en conséquence de quoi les centres catalytiques au cuivre n’étaient plus disponibles pour d’autres réactions. On a par ailleurs observé, dans le cristal de la zéolithe, que seuls quelques atomes de cuivre déployaient leur effet catalytique.
Des chercheurs du PSI ont renoué avec ces travaux et ont développé pour la première fois un processus, au terme duquel le produit final qui quitte le réacteur est du méthanol, sans qu’il ait fallu utiliser de solvant. Ils ont réussi à maîtriser le problème de l’adsorption du méthanol et nettement augmenté le nombre de centres de cuivre actifs dans la zéolithe. Par ailleurs, ils ont trouvé un moyen pour réactiver régulièrement le catalyseur par apports d’oxygène dans le réacteur, de manière à ce que les centres de cuivre soient à nouveau actifs après chaque cycle de réaction. « Cela nous permet d’obtenir de nombreux cycles de transformation avant que le catalyseur ne doive être remplacé », explique la chercheuse Evalyn Mae Alayon, qui a développé le procédé dans le cadre de sa thèse de doctorat.
Lors du développement et de l’amélioration de la nouvelle méthode de fabrication, les chercheurs du PSI ont profité de l’excellence de l’infrastructure que le PSI met à leur disposition avec ses grands instruments de recherche. Ils ont ainsi pu démontrer le succès leur procédé à la ligne de faisceau SuperXAS de la Source de lumière suisse (SLS), en y lisant l’activité catalytique des centres de cuivre au niveau des changements structurels de ces derniers. Leur objectif à venir est d’améliorer encore le design du catalyseur à l’aide de ces technologies aux rayons X. Jeroen A. van Bokhoven est enthousiasmé par ces perspectives. Mais le succès actuel l’emplit déjà de fierté, car la transformation catalytique du méthane en méthanol a été longtemps considérée parmi les chimistes comme la « golden reaction », et sa réalisation était très convoitée. Si tout cela devait déboucher un jour sur une réalité industrielle, on devrait la fin du gaspillage mondial du méthane en partie aux efforts des chercheurs du PSI.