Un chimiste étudie les éléments superlourds
L’objectif de Robert Eichler est de déterminer les propriétés chimiques des atomes superlourds. Mais ces derniers sont complexes à fabriquer; et à peine a-t-on réussi à en créer un, qu’il se désintègre aussitôt. Mais ce chef de groupe de recherche et ses collaborateurs ne baissent pas les bras pour autant et commencent par tester leur dispositif de mesure avec des atomes suppléants. Leur rêve: créer un jour des atomes qui seraient encore plus gros que tous ceux que l’on connaît aujourd’hui, mais ne se désintégreraient pas. La carte des chimistes pourrait en effet comprendre un îlot de stabilité qui n’a pas encore été découvert pour l’instant.
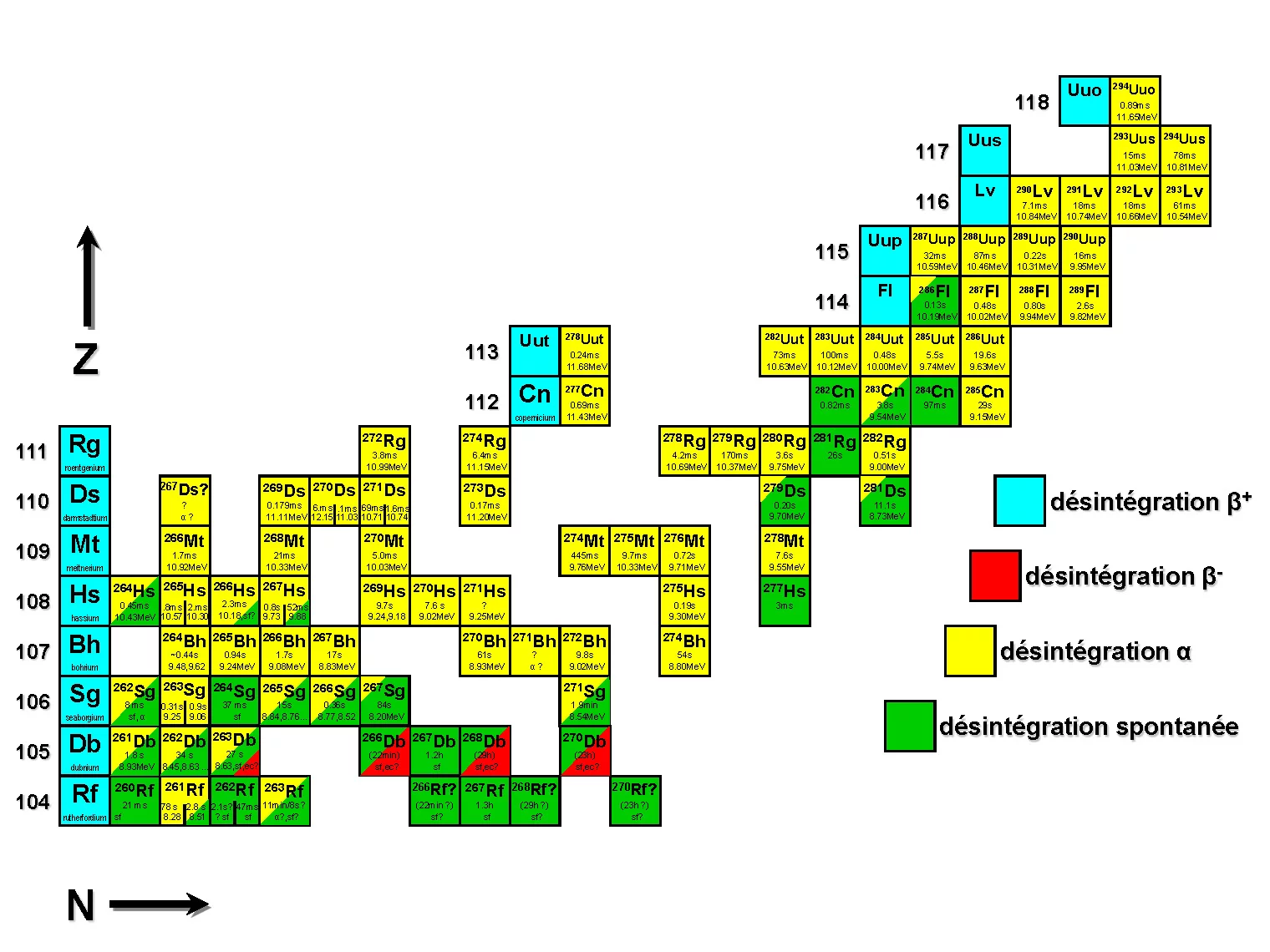
îlot de stabilitéau-delà des éléments énumérés ici. (Image: Robert Eichler)
Si le scientifique Robert Eichler était un animal, ce serait peut-être le serpent. Car les serpents se contentent d’un repas tous les deux ou trois jours. Or Robert Eichler se contente de peu, lui aussi, quand il est question des objets sur lesquels porte sa recherche: il lui arrive de devoir attendre plusieurs jours avant d’en obtenir un seul dans sa chambre d’essai. Ce chercheur et ses collègues étudient en effet de minuscules objets exotiques: les atomes individuels des éléments superlourds.
A noter que ce qualificatif de lourd
doit être pris dans un sens relatif. Il n’a rien en commun avec ce que nous trouvons lourd à soulever au quotidien, comme le fer ou le plomb. Non, ce dont il est question ici, c’est du poids des différents atomes dont un élément chimique donné est composé (voir encadré Le tableau périodique des éléments
).
Atomes artificiels
Les atomes superlourds que traque Robert Eichler sont évidemment toujours beaucoup trop petits pour être visibles à l’œil nu. Et pourtant, comparés à leurs congénères
– les atomes d’oxygène, de soufre ou d’or, par exemple – ils sont si gros et si exceptionnels qu’ils ne se rencontrent pas à l’état naturel; ils doivent être fabriqués au moyen de grands accélérateurs de particules en conditions de laboratoire.
Doubna est une ville de 70 000 habitants, située au bord de la Volga, à quelque 100 kilomètres au nord de Moscou. Ses armoiries s’ornent de trois symboles: les masses d’eau de son fleuve, un chêne – doub
, en russe, signifie chêne
– et un atome. Car l’institution la plus importante de Doubna est sans doute l’Institut unifié de recherches nucléaires. Il abrite plusieurs accélérateurs de particules. L’une de ses spécialités est la fabrication d’atomes d’éléments superlourds et l’étude de ces créatures atypiques et massives.
Souvenirs d’enfance en Russie
Chaque année, quelque 3500 chercheurs externes se rendent au PSI pour y utiliser les grands instruments de recherche dont ils ne disposent pas chez eux, à leur institut. Robert Eichler et ses collaborateurs du PSI font l’inverse: ils se rendent régulièrement à Doubna avec leur dispositif de mesure, afin d’y mener une partie de leur expérience impossible à réaliser au PSI. Doubna est assez isolée, mais cela ne gêne pas Robert Eichler. Au contraire. Car elle fait partie de ses souvenirs d’enfant. Le chercheur a en effet grandi dans l’ex-RDA et passé plusieurs années de sa jeunesse à Doubna, sur les rives de la Volga. Son père, un scientifique, avait été appelé à deux reprises à l’Institut unifié de recherches nucléaires et sa famille l’avait accompagné. Pendant cette période, Robert Eichler est allé à l’école à Doubna. Tout cela fait que j’ai une relation particulière à l’Institut
, reconnaît-il.
Certains chercheurs de relève apprécient aussi cette collaboration internationale: Non seulement, les éléments superlourds forment un champ de recherche exotique, explique Robert Eichler, chef du groupe de recherche Eléments superlourds au PSI depuis 2002. Mais la perspective de collaborer avec des chercheurs qui travaillent dans une aire culturelle complètement différente attire aussi les jeunes collègues et élargit leur horizon.
.
Robert Eichler et ses collaborateurs préparent tout sur place, à l’Institut Paul Scherrer. Ils montent leur chambre d’essai et exploitent l’électronique spéciale, développées à l’interne au PSI. L’équipe de Richard Eichler développe et construit par ailleurs ses propres détecteurs de particules, qui supportent des conditions comme aucun autre au monde. Grâce à ce volet de notre travail, notre groupe est multidisciplinaire
, précise le chercheur. Ingénieurs, techniciens, physiciens et chimistes y travaillent côte à côte. Le fait que toutes ces personnes réfléchissent de manière différente est utile
, reconnaît le chercheur. Avant de lâcher en souriant: Mais comme chaque discipline a sa propre batterie d’expressions scientifiques, cela représente aussi un certain défi. Nous devons parfois commencer par trouver un langage commun.
.
Une fois que le montage de la chambre d’essai est terminé au PSI, les chercheurs commencent par la tester avec des atomes ordinaires qui ne sont pas aussi lourds. Ces atomes suppléants, Robert Eichler les appelle des atomes homologues
. Ce qualificatif signifie qu’au niveau chimique, ils sont censés se comporter de manière très similaire aux éléments superlourds avec lesquels Robert Eichler aimerait ultérieurement mener ses expériences à Doubna. Exemple de groupe d’éléments homologues: le groupe des gaz nobles – néon, argon, xénon – qui illuminent les enseignes au néon de couleurs différentes. Dans le tableau périodique, les éléments qui sont des homologues les uns des autres se trouvent dans la même colonne. Les éléments homologues qu’utilise Rober Eichler sont par exemple le tungstène ou le thallium. Le tungstène sert d’homologue au seaborgium, un élément superlourd; quant au thallium, il est celui de l’élément 113 qui n’a pas encore de nom (voir encadré).
De la chimie avec des atomes individuels
Mais Robert Eichler ne serait pas un vrai scientifique s’il n’était pas prêt à se laisser surprendre: Ce que nous cherchons à découvrir, c’est si le seaborgium se comporte vraiment en homologue du tungstène, et si l’élément 113 est vraiment l’homologue du thallium
, explique-t-il. Or s’il devait s’avérer que les éléments superlourds présentent un comportement chimique différent de celui de leurs homologues présumés, il faudrait trouver des explications. Nous devrions alors nous demander si et pourquoi l’architecture des atomes superlourds déroge aux règles habituelles
, poursuit le chercheur.
Pour découvrir si c’est le cas, Robert Eichler et son équipe doivent faire de la chimie avec des éléments superlourds. Ce qui est pour le moins inhabituel, car d’ordinaire, les effets chimiques s’observent dans la masse: les expériences chimiques classiques consistent à se demander ce qui se passe quand on mélange tel liquide avec tel autre, par exemple. Or pour qualifier le nombre d’atomes qui interagissent dans ces cas de figure, il faut des termes comme trilliards et quadrillions. A priori, le projet de Robert Eichler de mener des expériences tout à fait similaires avec des atomes individuels paraît donc ridicule.
Et pourtant, ce n’est pas impossible. Avec ces atomes individuels, nous pouvons tout à fait mener certaines expériences, explique Robert Eichler. A l’intérieur de notre chambre d’essai, nous leur offrons une surface spéciale et nous regardons combien de temps ils s’y fixent. Cela nous indique dans quelle mesure ils sont prêts à s’associer. Or en chimie, cette question est centrale.
Lors d’étapes ultérieures, Robert Eichler et ses collègues peuvent offrir à leurs atomes des surfaces à base d’autres matériaux ou varier la température de ces surfaces.
Les atomes lourds sont des atomes instables
Le fait qu’en dépit d’efforts considérables, Robert Eichler et ses collègues puissent seulement fabriquer des exemplaires individuels de leurs atomes superlourds n’est qu’un aspect du problème. A cela s’ajoute que des noyaux atomiques de cette taille sont fondamentalement instables. Autrement dit, ces atomes sont radioactifs et à peine apparus, ils se désintègrent – cette désintégration produit alors les atomes plus petits d’autres éléments. Autrement dit, Robert Eichler et ses collègues font de la chimie avec des atomes radioactifs, c’est-à-dire de la radiochimie.
Est-ce que cela ne fait pas une impression bizarre de manipuler cette radioactivité? Mais non!, répond Robert Eichler en riant. Nous ne fabriquons vraiment que des atomes individuels. Bien sûr que leur désintégration est radioactive. Mais entre les murs de béton de notre laboratoire, il règne une quantité bien plus élevée de radioactivité naturelle que cette poignée d’atomes que nous créons.
Les expériences de Robert Eichler se heurtent encore à un autre obstacle: plus les noyaux atomiques sont gros, plus ils ont tendance à être instables et plus ils sont éphémères. Certains éléments superlourds qu’étudie Robert Eichler ont une durée de vie moyenne d’une demi-seconde, d’autres d’un centième de seconde seulement. Une fois que les expérimentateurs ont fabriqué l’un de leurs rares objets d’étude, ils n’ont donc que très peu de temps pour travailler.
Mais pour Robert Eichler, ce n’est pas seulement un inconvénient, au contraire. Tous les éléments radioactifs ont déjà une durée de vie moyenne connue, explique le chercheur. C’est un élément que nous pouvons exploiter dans nos expériences comme une horloge interne, qui démarre automatiquement avec la fabrication de l’atome et est toujours utilisable comme étalon.
Le moment moyen de la désintégration de l’atome confirme entre autres aux chercheurs qu’ils ont bien étudié l’élément correspondant.
Au-delà des éléments radioactifs: l’îlot de stabilité
Pour les chimistes, le tableau périodique des éléments est une carte. Mais il en existe encore une deuxième. Cette autre représentation des différents types d’atomes va pour ainsi dire en profondeur. Car à proprement parler, pour chaque élément chimique, les atomes sont susceptibles d’adopter plusieurs formes: ils peuvent avoir un nombre plus ou moins élevé de neutrons autour de leur noyau, alors qu’il s’agit toujours du même élément. La carte qui représente cette réalité est la carte des nucléides, appelée aussi carte des isotopes.
Pour les physiciens nucléaires, la carte des nucléides est essentielle, mais elle l’est aussi pour tous ceux qui étudient les éléments superlourds. Car à la fin de la carte des nucléides figure un grand vide. Et on ignore encore s’il restera vide à jamais, car dans cette zone, il n’est plus possible de former des configurations atomiques stables, même en laboratoire. On ne sait pas non plus si à l’écart de l’isthme que forment les atomes stables connus à ce jour, il existe encore un autre îlot de stabilité.
Ce nom d’îlot de stabilité vient d’ailleurs des scientifiques. On soupçonne son existence depuis la fin des années 1960. D’un geste routinier, l’index de Robert Eichler parcourt la grande carte des nucléides affichée au mur de son bureau: Cet îlot d’atomes et d’isotopes stables pourrait se trouver là-haut, indique-t-il. C’est là que nous voulons nous rendre un jour pour voir ce que nous y découvrons.
Sur cette question, c’est le goût de la découverte qui anime Robert Eichler, tout comme nombre de physiciens et de chimistes. Comme les marins d’antan, leur objectif est de parcourir les zones encore non cartographiées pour obtenir une image du monde aussi complète et précise que possible.
Un de mes collègues a désigné ce que nous faisions exactement en ces termes: notre objet de recherche, c’est l’image du monde, raconte Robert Eichler. Et c’est vrai: notre recherche témoigne de la soif de connaissance de l’humanité.
Texte: Institut Paul Scherrer/Laura Hennemann
Le tableau périodique des éléments
Les éléments chimiques dont est faite toute la matière sur notre planète et dans le reste de l’univers peuvent être classés par ordre croissant, en fonction de la taille de leurs atomes. Cette succession de lignes et de colonnes compose ce qu’on appelle le tableau périodique des éléments. Avec ses cases de couleur, il est dans toutes les salles de chimie des établissements scolaires. L’élément numéro 8 est l’oxygène, le numéro 16 le soufre, le 29 est le cuivre, le 47 l’argent et le 79 l’or. A côté de ces noms familiers, figurent de nombreux éléments auxquels sans doute seuls les chimistes ont affaire: le béryllium (numéro 4), l’yttrium (39) ou le hafnium (72).Les numéros du tableau ne sauraient pourtant être multipliés jusqu’à l’infini. Car à partir du numéro 84, les noyaux atomiques sont si gros qu’ils sont fondamentalement instables. Ces noyaux – et donc les atomes – se désintègrent. Autrement dit, il s’agit d’éléments radioactifs qui émettent un rayonnement ionisant et se désintègrent; cette désintégration donne les atomes plus petits d’autres éléments. C’est dans cette catégorie que l’on range les éléments radioactifs les plus connus, comme l’uranium (numéro 92) et le plutonium (94).
Enfin, les éléments les plus gros – à partir du numéro 95 – sont si instables qu’on ne les rencontre pas à l’état naturel. Ils peuvent être fabriqués en laboratoire au prix d’efforts considérables, mais se désintègrent presque aussitôt en atomes plus petits. Typiquement, la durée de vie moyenne de ces éléments est de moins d’une seconde.
La création artificielle de ces éléments est possible seulement depuis quelques décennies, grâce aux grands accélérateurs de particules. Récemment, en janvier 2016, l’Union internationale de chimie pure et appliquée (UIPAC) a officiellement ajouté plusieurs éléments superlourds au tableau périodique: ce dernier comprend désormais les numéros 113, 115, 117 et 118. Le 8 juin 2016, l’UIPAC a publié les noms proposés suivants pour les nouveaux éléments: Nihonium, Moscovium, Tennessine et Oganesson.
Contact
Robert Eichler, chef du groupe de recherche Eléments superlourds, laboratorire pour la recherche radiochimique, Institut Paul ScherrerTéléphone: +41 56 310 41 20, e-mail: robert.eichler@psi.ch [allemand, anglais]