Wie ein Chemiker superschwere Elemente erforscht
Robert Eichler will die chemischen Eigenschaften der superschweren Atome bestimmen. Doch erstens sind diese aufwändig herzustellen; und hat man endlich eines erschaffen, zerfällt es gleich wieder. Doch der Forschungsgruppenleiter und seine Mitarbeitenden geben nicht auf – und testen ihren Messaufbau zunächst mit Stellvertreter-Atomen. Der Traum: Eines Tages Atome zu erschaffen, die noch grösser sind als alle bisher bekannten und trotzdem nicht schnell zerfallen. Auf der Landkarte der Chemiker könnte sich nämlich eine bislang unentdeckte Insel der Stabilität befinden.
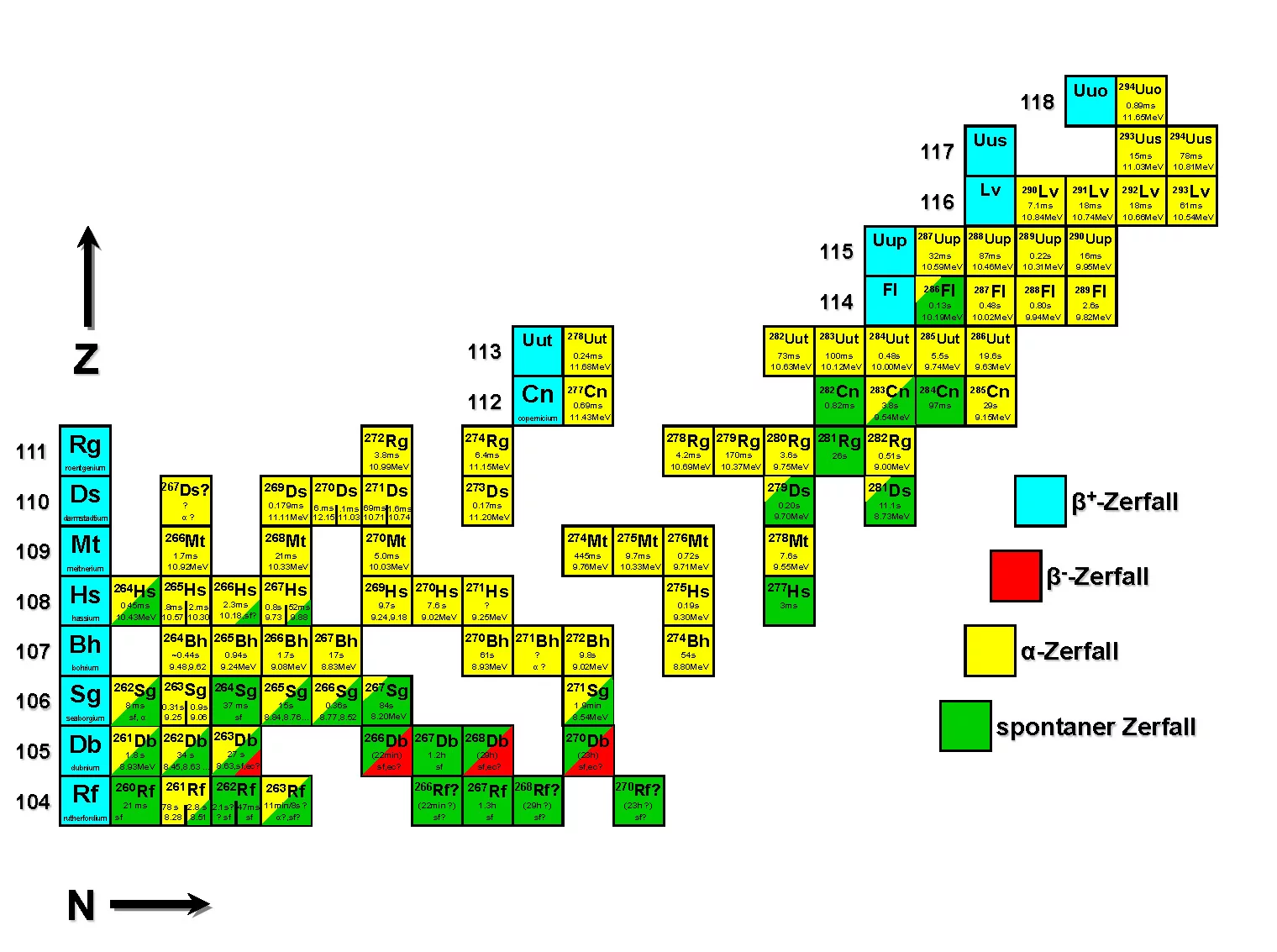
Insel der Stabilitätjenseits der hier gelisteten Elemente. (Bild: Robert Eichler)
Wäre der Wissenschaftler Robert Eichler ein Tier, dann vielleicht eine Schlange. Schlangen benötigen nur alle paar Tage eine Mahlzeit. Ähnlich bescheiden ist Eichler, wenn es um seine Forschungsobjekte geht: Teilweise muss er mehrere Tage warten, um eines in seine Versuchskammer zu bekommen. Denn Eichler und seine Kollegen untersuchen ebenso winzige wie exotische Dinge – die einzelnen Atome der superschweren Elemente.
Schwer
ist dabei relativ zu sehen. Schon gar nicht geht es um das, was wir im Alltag als schwer erleben, also um Stoffe wie Eisen oder Blei. Nein, es geht um das Gewicht der einzelnen Atome, aus denen ein bestimmtes chemisches Element besteht (siehe Infokasten: Das Periodensystem der Elemente).
Künstliche Atome
Die superschweren Atome, denen Robert Eichler auflauert, sind selbstredend noch immer viel zu klein für das menschliche Auge. Und doch sind sie im Vergleich mit ihren Artgenossen – den Atomen von Sauerstoff, Schwefel oder Gold beispielsweise – so gross und aussergewöhnlich, dass sie nicht in der Natur vorkommen; sie müssen mithilfe grosser Teilchenbeschleuniger unter Laborbedingungen hergestellt werden.
Dubna. Die Russische Stadt mit 70‘000 Einwohnern liegt gute hundert Kilometer nördlich von Moskau am Fluss Wolga. Das Wappen der Stadt zeigt viel Wasser und einen Eichenbaum – Dub
bedeutet Eiche auf Russisch. Drittens aber prangt auf dem Wappen das Symbol eines Atoms. Denn die vielleicht bedeutendste Einrichtung der Stadt ist das Vereinigte Institut für Kernforschung. Hier befinden sich mehrere Teilchenbeschleuniger. Eine Spezialität des Instituts in Dubna ist die Herstellung von Atomen superschwerer Elemente und die Forschung mit diesen wuchtigen Sonderlingen.
Kindheitserinnerungen an Russland
Jährlich kommen rund 2500 externe Forschende ans PSI, um hier die Grossforschungsanlagen zu nutzen, die ihre Heimatinstitute nicht haben. Robert Eichler und seine Mitarbeitenden vom PSI machen das Umgekehrte: Sie fahren regelmässig mitsamt ihrem Messaufbau nach Dubna, um dort den Teil ihrer Experimente durchzuführen, der am PSI nicht möglich ist. Die abgeschiedene Lage der Stadt stört Eichler nicht. Im Gegenteil, denn er verbindet mit Dubna Kindheitserinnerungen. In der damaligen DDR aufgewachsen, verbrachte Robert Eichler in seiner Jungend viele Jahre in der Stadt an der Wolga. Sein Vater war Wissenschaftler und wurde zwei Mal für mehrere Jahre ans Vereinigte Institut für Kernforschung geholt; die Familie ging mit und Eichler besuchte in dieser Zeit in Dubna die Schule. Durch diesen Hintergrund habe ich einen besonderen Bezug zum Institut
, bekennt Eichler.
So mancher Nachwuchsforschende weiss diese internationale Kollaboration zu schätzen: Nicht nur sind die superschweren Elemente ein exotisches Forschungsgebiet – auch die Zusammenarbeit mit Forschern, die in einem anderen Kulturkreis arbeiten, zieht jüngere Kollegen an und erweitert ihren Horizont
, so Eichler, der seit 2002 Gruppenleiter der Forschungsgruppe Schwere Elemente
am PSI ist.
Hier am PSI bereiten Eichler und seine Mitarbeitenden alles vor. Sie bauen ihre Versuchskammern auf und setzen die besondere Elektronik ein, die eigens am PSI entwickelt wurde. Eichlers Team entwickelt und baut zudem eigene Teilchendetektoren, die Bedingungen aushalten wie weltweit kaum ein anderer Detektor. Dieser Teil der Arbeit macht unsere Gruppe multidisziplinär
, sagt Eichler. Ingenieure, Techniker, Physiker und Chemiker arbeiten hier Seite an Seite. Hilfreich ist, dass alle diese Personen unterschiedlich denken. Es ist aber auch eine gewisse Herausforderung, denn jede Disziplin hat einen eigenen Satz wissenschaftlicher Ausdrücke. Manchmal müssen wir erst einmal eine gemeinsame Sprache finden
, schmunzelt Eichler.
Wenn die Versuchskammer dann am PSI fertig gestellt ist, testen die Forschenden sie zunächst mit alltäglichen, nicht ganz so schweren Atomen. Diese Stellvertreter-Atome nennt Eichler, der Chemiker, homologe
Atome. Das bedeutet, dass sie sich chemisch sehr ähnlich verhalten sollen wie die superschweren Elemente, mit denen er später in Dubna experimentieren möchte. Ein Beispiel für eine Gruppe von homologen Elementen sind die Edelgase: Neon, Argon, Xenon. Sie alle bringen Leuchtreklamen zum Scheinen, wenn auch in unterschiedlichen Farben. Zueinander homologe Elemente stehen im Periodensystem der Elemente in derselben Spalte untereinander. Die homologen Elemente, die Eichler verwendet, sind beispielsweise Wolfram oder Thallium. Wolfram dient ihm als Homologon für das superschwere Seaborgium; Thallium für das noch namenlose Element 113 (siehe Infokasten).
Chemie mit einzelnen Atomen
Doch Eichler wäre kein echter Wissenschaftler, wenn er nicht auch Überraschungen zulassen würde: Was wir herausfinden wollen ist, ob Seaborgium sich wirklich homolog zu Wolfram verhält und Element 113 wirklich homolog zu Thallium ist.
Sollten die superschweren Elemente sich chemisch anders verhalten als ihre vermeintlichen Homologen, müssten Erklärungen dafür gefunden werden. Wir würden dann überlegen, ob und wenn ja warum die Architektur der superschweren Atome von den üblichen Regeln abweicht.
Um dies herauszufinden, müssen Eichler und sein Team Chemie betreiben mit den superschweren Elementen. Und das wiederum ist mindestens ungewöhnlich, denn chemische Effekte werden normalerweise in der Masse betrachtet: Was passiert, wenn man diese Flüssigkeit mit jener mischt? – So beispielsweise laufen klassische chemische Experimente ab. Wörter wie Trilliarde und Quadrillion sind nötig, um die Anzahl der Atome zu beschreiben, die in diesen Fällen aufeinandertreffen und interagieren. Es erscheint lächerlich, dass Eichler ganz ähnliche Experimente mit einzelnen Atomen betreiben möchte.
Und doch ist es nicht unmöglich. Wir können durchaus einiges mit diesen einzelnen Atomen anstellen: Im Inneren unserer Versuchskammer bieten wir ihnen eine spezielle Oberfläche an und schauen, ob und wenn ja wie lange sie sich darauf festsetzen
, erklärt Eichler. Das verrät uns etwas über die Bindungswilligkeit der Atome und das wiederum ist eine zentrale Frage der Chemie.
In weiteren Schritten können Eichler und seine Kollegen den Atomen Oberflächen aus anderen Materialien anbieten; oder die Temperatur dieser Oberfläche variieren.
Schwere Atome sind instabile Atome
Dass Eichler und seine Kollegen selbst mit beträchtlichem Aufwand nur einzelne Exemplare ihrer superschweren Atome erschaffen können, ist noch nicht das ganze Problem. Hinzu kommt, dass die Atomkerne dieser Grösse grundsätzlich instabil sind. Anders gesagt: Diese Atome sind radioaktiv und zerfallen schon kurz nach ihrer Entstehung in die kleineren Atome anderer Elemente. Eichler und seine Kollegen betreiben also Chemie mit radioaktiven Atomen – oder kurz: Radiochemie.
Ob es kein mulmiges Gefühl ist, mit dieser Radioaktivität zu hantieren? Eichler lacht: Aber nein! Wir stellen ja wirklich nur einzelne Atome her. Natürlich zerfallen diese radioaktiv. Aber in den Betonwänden unseres Labors ist ein vielfach höheres Mass an natürlicher Radioaktivität als diese Handvoll Atome, die wir erzeugen.
Und noch eine Hürde gibt es für Eichlers Experimente: Je grösser die Atomkerne, desto instabiler sind sie tendenziell – das heisst: desto kurzlebiger. Die superschweren Elemente, an denen Eichler forscht, haben daher teilweise mittlere Lebensdauern von einer halben Sekunde; andere sogar nur von einer hundertstel Sekunde. Haben die Experimentatoren also eines ihrer seltenen Untersuchungsobjekte erschaffen, bleibt ihnen nur sehr wenig Zeit, damit zu arbeiten.
Doch Eichler sieht auch das nicht als Nachteil – im Gegenteil. Jedes radioaktive Element hat eine eigene, bereits bekannte mittlere Lebensdauer. Das können wir in unseren Experimenten als eine innere Uhr nutzen, die ganz automatisch mit der Erzeugung des Atoms startet und immer mitläuft
, so Eichler. Unter anderem bestätigt der durchschnittliche Zeitpunkt des Zerfalls der Atome den Forschenden, dass sie das entsprechende Element untersucht haben.
Jenseits der radioaktiven Elemente: Die Insel der Stabilität
Das Periodensystem der Elemente ist die Landkarte der Chemiker. Doch es gibt noch eine zweite Karte, eine zweite Darstellung der Atomsorten, die sozusagen in die Tiefe geht. Denn genau genommen gibt es zu jedem chemischen Element nicht nur eine Form, die seine Atome annehmen können: Die Atome können etwas mehr oder auch etwas weniger Neutronen in ihrem Atomkern haben und bleiben doch das gleiche Element. Die Landkarte, die diesen Umstand abbildet, ist die Nuklidkarte, auch Isotopenkarte genannt.
Die Nuklidkarte ist einerseits für Kernphysiker essentiell und andererseits für alle, die die superschweren Elemente erforschen. Denn an diesem Ende der Nuklidkarte gibt es eine grosse weisse Fläche. Und noch ist nicht klar, ob sie für immer weiss bleiben wird, weil sich hier selbst im Labor keine stabilen Atomkonfigurationen mehr bilden lassen. Oder ob es doch noch – ein Stückchen ausserhalb der bisher bekannten Landzunge der stabilen Atome – eine einsame Insel der Stabilität gibt.
So nennen Wissenschaftler sie tatsächlich: Insel der Stabilität. Seit den späten 1960er Jahren vermutet man ihre Existenz. Robert Eichler fährt mit dem Finger routiniert über die grosse Nuklidkarte, die in seinem Büro an der Wand hängt: Hier oben könnte diese Insel der stabilen Atome und Isotope liegen. Da wollen wir eines Tages hingelangen und schauen, was wir vorfinden.
Es ist der pure Entdeckergeist, der Eichler und viele andere Physiker und Chemiker in dieser Frage antreibt. Wie frühere Seefahrer wollen sie die weissen Flecken auf der Karte bereisen, um ein umfassenderes, exakteres Weltbild zeichnen zu können.
Genau so hat es einer meiner Kollegen mal ausgedrückt: Wir machen Weltbild-Forschung
, erzählt Eichler. Und das stimmt: In unserer Forschung zeigt sich das generelle menschliche Streben nach Erkenntnis.
Text: Paul Scherrer Institut/Laura Hennemann
Das Periodensystem der Elemente
Die chemischen Elemente, aus denen alle Materie auf unserem Planeten und im restlichen Universum zusammengesetzt ist, lassen sich nach steigender Grösse der Atomkerne anordnen. Zeile für Zeile und Spalte für Spalte ergibt sich dabei das sogenannte Periodensystem der Elemente – eine Tabelle aus bunten Rechtecken, die sich im Chemieraum jeder Schule befindet. Element Nummer 8 ist Sauerstoff, die Nummer 16 ist Schwefel, 29 ist Kupfer, 47 Silber, 79 Gold. Neben vertrauten Namen finden sich mindestens ebenso viele, mit denen wohl nur Chemiker in Berührung kommen: Beryllium (Nummer 4), Yttrium (39) oder Hafnium (72).Beliebig hoch jedoch können diese Zahlen nicht ohne Weiteres werden. Ab der Nummer 84 sind die Atomkerne so gross, dass sie grundsätzlich instabil sind. Diese Atomkerne – und damit die Atome – zerfallen. Was so viel bedeutet wie: Diese Elemente sind radioaktiv, sie senden ionisierende Strahlung aus und zerbrechen dabei in die kleineren Atome anderer Elemente. In diese Kategorie fallen die bekannten radioaktiven Elemente Uran (Nummer 92) und Plutonium (94).
Die ganz grossen Elemente schliesslich – ab Nummer 95 – sind so hochgradig instabil, dass sie in der Natur gar nicht zu finden sind. Mit beträchtlichem Aufwand lassen sie sich zwar im Labor künstlich erschaffen – doch zerfallen sie gleich darauf wieder in kleinere Atome. Die mittlere Lebensdauer dieser Elemente beträgt typischerweise weniger als eine Sekunde.
Die künstliche Erschaffung dieser Elemente ist erst seit wenigen Jahrzehnten und dank grosser Teilchenbeschleuniger möglich. Und so hat erst kürzlich – im Januar 2016 – die Internationale Union für reine und angewandte Chemie (IUPAC) das Periodensystem der Elemente offiziell um einige superschwere Elemente erweitert: Seither sind auch die Nummern 113, 115, 117 und 118 gelistet. Am 8. Juni 2016 hat die IUPAC folgende vorgeschlagene Namen für die neuen Elemente publiziert: Nihonium, Moscovium, Tennessine und Oganesson.
Kontakt/Ansprechpartner
Robert Eichler, Leiter der Arbeitsgruppe Schwere Elemente, Labor für Radiochemie, Paul Scherrer InstitutTelefon: +41 56 310 41 20, E-Mail: robert.eichler@psi.ch [Deutsch, Englisch]