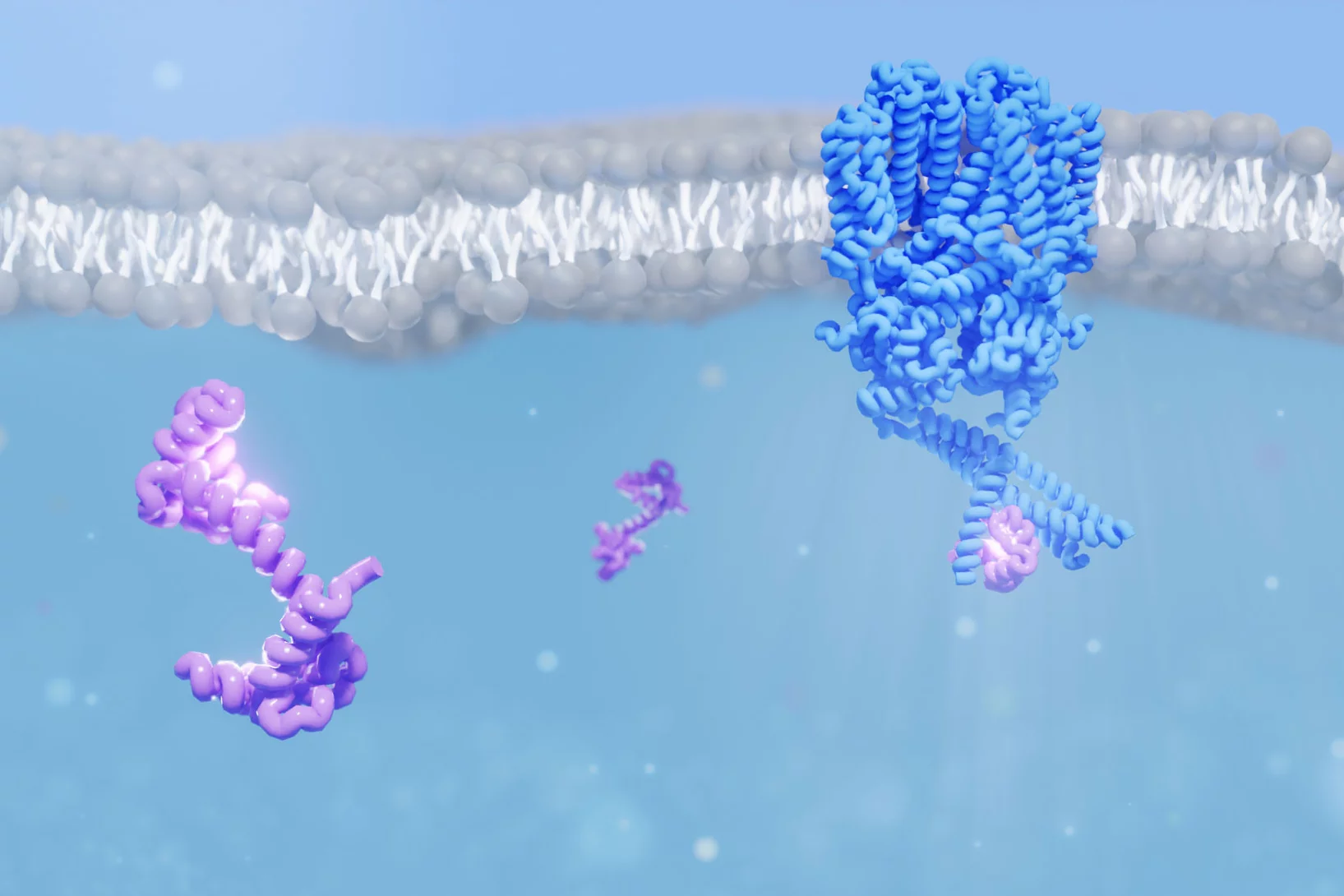
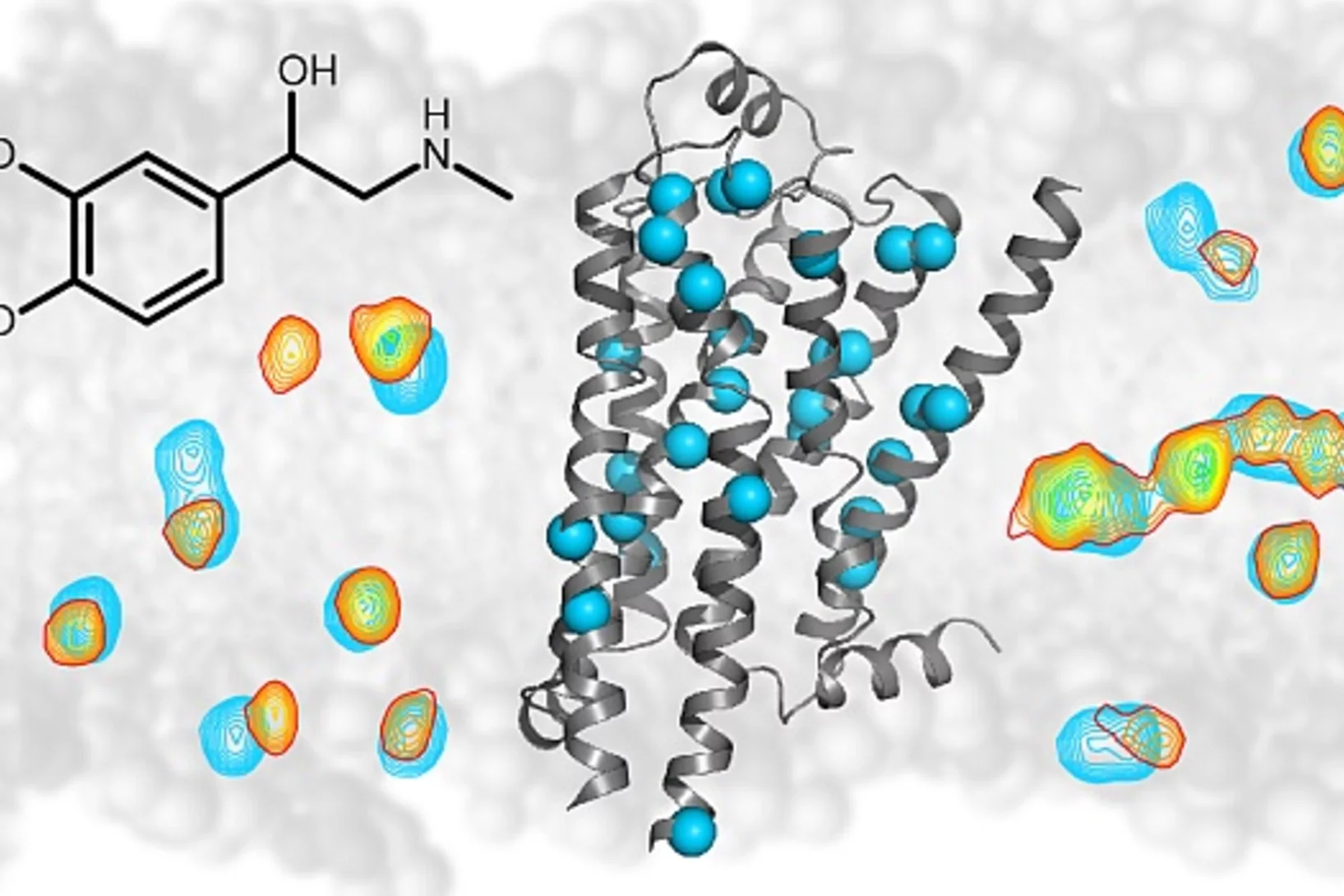
Calcium sensor helps us to see the stars
New insight into how the protein calmodulin interacts with an ion channel in the eye could explain how our eyes achieve remarkable sensitivity to dim light.
So beginnt das Sehen
PSI-Forschende haben untersucht, was als Allererstes im Auge abläuft, wenn Licht auf die Netzhaut trifft.
Medikamente mit Licht an- und abschalten
Forschende des PSI drehen einen molekularen Film eines Krebsmedikaments mit Lichtschalter. Das eröffnet neue Einblicke für Wirkstoffentwickler.
A new spin on sample delivery for membrane proteins
Proteins hover in front of the X-ray beam at a Swiss Light Source beamline. Now, spinning thin films bring on board these trickiest of proteins.
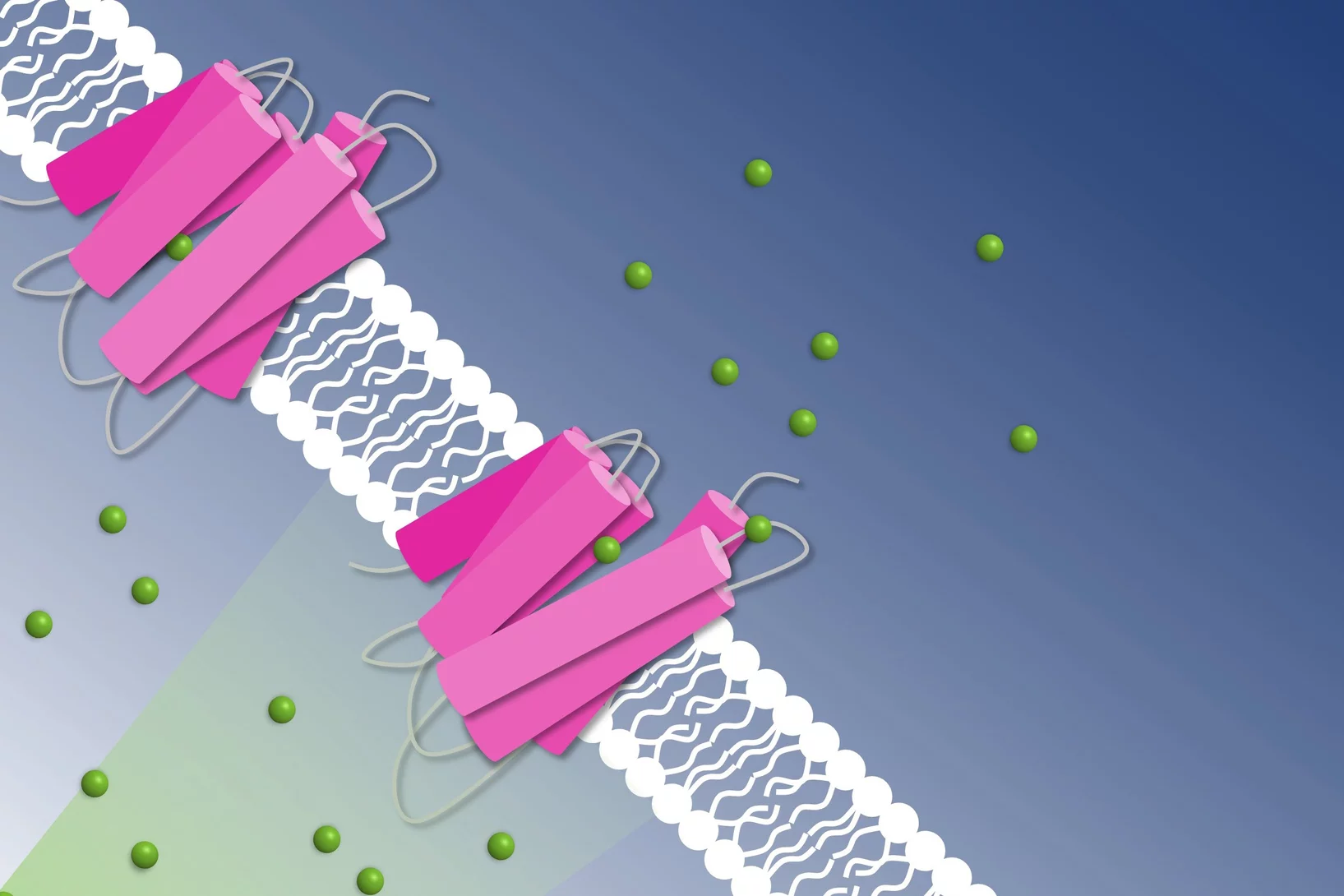
How to get chloride ions into the cell
A molecular movie shot at PSI reveals the mechanism of a light-driven chloride pump
Neuer, besserer Corona-Virus-Schnelltest
Der Test erkennt verschiedene Virus-Varianten und verbessert die Krankheitsprognose.
Das Zellskelett als Ziel für neue Wirkstoffe
Mit einer Kombination aus Computersimulation und Laborexperiment haben PSI-Forschende neue Bindungsstellen für Medikamente an dem lebenswichtigen Protein Tubulin identifiziert.
PSI Thesis Medal 2021 for pioneering Structural Biology at SwissFEL
Dr. Petr Skopintsev received PSI Thesis Medal 2021 for his work on the sodium pump KR2.
Mechanismus einer lichtgetriebenen Natriumpumpe aufgeklärt
Forschenden des Paul Scherrer Instituts PSI ist es erstmals gelungen, eine lichtgetriebene Natriumpumpe von Bakterienzellen in Aktion aufzunehmen. Die Erkenntnisse versprechen Fortschritte bei der Entwicklung von neuen Methoden in der Neurobiologie. Für ihre Untersuchungen nutzten die Forschenden den neuen Freie-Elektronen-Röntgenlaser SwissFEL.
Metastasierung von Tumoren verhindern
Forschende des Paul Scherrer Instituts PSI sind gemeinsam mit Kollegen des Pharmaunternehmens F. Hoffmann-La Roche AG der Entwicklung eines Wirkstoffes gegen die Metastasierung von bestimmten Krebsarten einen wichtigen Schritt nähergekommen. Mithilfe der Synchrotron Lichtquelle Schweiz SLS entschlüsselten sie die Struktur eines Rezeptors, der entscheidend an der Wanderung von Krebszellen beteiligt ist.
Molekulare Energiemaschine als Filmstar
Forschende des PSI haben mithilfe der Synchrotron Lichtquelle Schweiz SLS eine molekulare Energiemaschine in Bewegung aufgenommen und so aufgedeckt, wie die Energiegewinnung an Zellmembranen funktioniert. Dazu entwickelten sie eine neue Untersuchungsmethode, die die Analyse von zellulären Vorgängen deutlich effektiver machen könnte als bislang.
Molekulare Schere stabilisiert das Zell-Zytoskelett
Forschende des Paul Scherrer Instituts PSI haben einen wichtigen Teil des Kreislaufs identifiziert, der den Auf- und Abbau des Zellskelettes reguliert. Dazu beobachteten sie mithilfe der Synchrotron Lichtquelle Schweiz SLS Molekül-Scheren bei der Arbeit.
Informationen in die Zelle bringen
Forschende des Paul Scherrer Instituts PSI haben einen wichtigen Teil eines Signalweges aufgeklärt, der Informationen durch die Zellmembran in das Innere einer Zelle überträgt. Dieser existiert bei allen Säugetieren und spielt unter anderem bei der Regulierung des Herzschlages eine wichtige Rolle. Die neuen Erkenntnisse könnten zu neuen Therapien führen.
Eine biotechnologische Revolution
Gebhard Schertler ist Leiter des Forschungsbereichs Biologie und Chemie am Paul Scherrer Institut PSI und Professor für Strukturbiologie an der ETH Zürich. In diesem Interview spricht er über die biologische Forschung am PSI und die Zukunft der Medikamentenentwicklung.
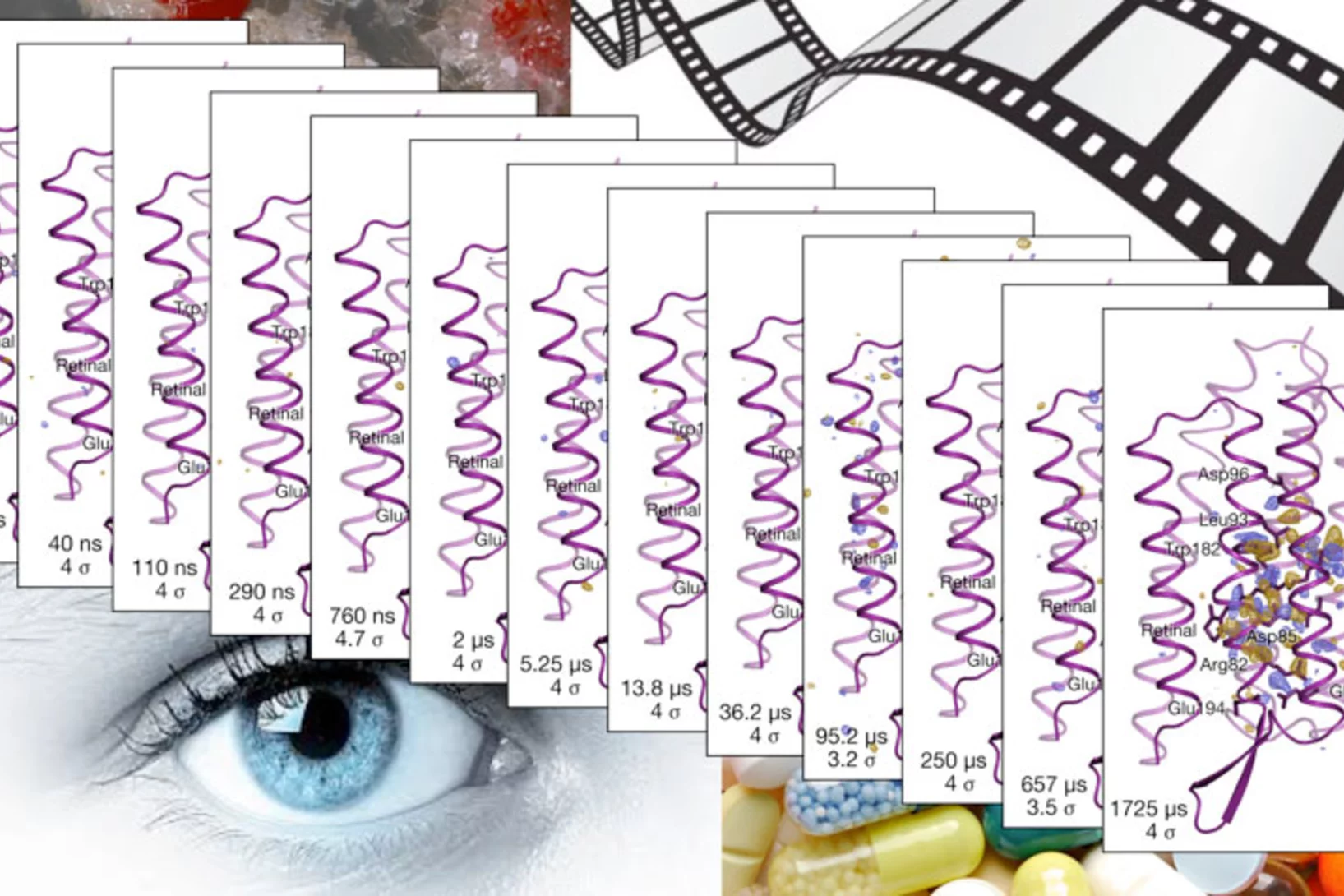
Biologischer Lichtsensor in Aktion gefilmt
Mithilfe eines Röntgenlasers hat ein Team unter Leitung von Forschenden des Paul Scherrer Instituts PSI einen der schnellsten Prozesse in der Biologie aufgezeichnet. Der dabei erzeugte molekulare Film enthüllt, wie der Lichtsensor Retinal in einem Proteinmolekül aktiviert wird. Solche Reaktionen kommen in zahlreichen Organismen vor. Der Film zeigt erstmals, wie ein Protein die Reaktion des eingebetteten Lichtsensors effizient steuert.
Hollywood im Würenlinger Wald
Mit dem Röntgenlaser SwissFEL wollen Forschende am PSI Filme von Biomolekülen in Aktion produzieren. So lässt sich aufzeigen, wie unser Auge funktioniert oder wie neue Medikamente wirken.
Bedeutung der Strukturanalyse von Biomolekülen unterstrichen
Der Nobelpreis für Chemie 2017 wurde für die Entwicklung der Strukturanalyse von biologischen Einzelmolekülen mittels ultragekühlter Elektronenmikroskopie verliehen. Die Preisvergabe unterstreicht die fundamentale Bedeutung der Strukturanalyse von Biomolekülen für die moderne Biologie – eines Forschungsgebiets, auf dem das Paul Scherrer Institut PSI in der Schweiz eine führende Rolle einnimmt.
In Start-up-Firmen ist das Machen überlebenswichtig
Lange war er Pharma-Manager bei Roche, jetzt ist er Gründer eines Biotech-Unternehmens auf dem Gelände des Paul Scherrer Instituts PSI: Michael Hennig kennt die Trends der Medizinbranche. Im Interview erklärt er, warum die Medizin der Zukunft die Innovationskraft öffentlich geförderter Forschung braucht und warum er für sein Start-up leadXpro die Nähe zum PSI gewählt hat.
Im kalten Wasser
Martin Ostermaier wollte aus der Komfortzone der Wissenschaft ausbrechen. Statt mit Pipetten setzt sich der Biochemiker nun mit Investoren und Patentrecht auseinander.
A three-dimensional movie of structural changes in bacteriorhodopsin
Snapshots of bacteriorhodopsinBacteriorhodopsin is a membrane protein that harvests the energy content from light to transport protons out of the cell against a transmembrane potential. Nango et al. used timeresolved serial femtosecond crystallography at an x-ray free electron laser to provide 13 structural snapshots of the conformational changes that occur in the nanoseconds to milliseconds after photoactivation. These changes begin at the active site, propagate toward the extracellular side of the protein, and mediate internal protonation exchanges that achieve proton transport.
Proteine in Aktion erwischen
Proteine sind unverzichtbare Bausteine des Lebens. Sie spielen eine entscheidende Rolle bei zahlreichen biologischen Prozessen. Forschende konnten nun zeigen, wie man mit Freie-Elektronen-Röntgenlasern wie dem SwissFEL am Paul Scherrer Institut PSI die ultraschnellen Abläufe, mit denen Proteine ihre Arbeit machen, erforschen kann. Freie-Elektronen-Röntgenlaser erzeugen extrem kurze und intensive Pulse aus Röntgenlicht. Weltweit sind derzeit erst zwei solcher Anlagen in Betrieb. Die Ergebnisse wurden heute im Wissenschaftsmagazin Nature Communications publiziert.
Den Tumor aushungern
Der PSI-Forscher Kurt Ballmer-Hofer beschäftigt sich mit der Frage, wie man Tumoren „aushungern“ könnte, indem man sie daran hindert, Blutgefässe zu entwickeln. Nach 40 Jahren Forschung, die viele grundsätzliche Erkenntnisse über die Bildung von Blutgefässen gebracht hat, ist das entscheidende Molekül inzwischen gefunden worden; weitere Forschung soll nun neue klinische Anwendungen möglich machen.
Centriolar CPAP/SAS-4 Imparts Slow Processive Microtubule Growth
Centrioles are fundamental and evolutionarily conserved microtubule-based organelles whose assembly is characterized by microtubule growth rates that are orders of magnitude slower than those of cytoplasmic microtubules. Here, we bring together crystallographic, biophysical, and reconstitution assays to demonstrate that the human centriolar protein CPAP (SAS-4 in worms and flies) binds and "caps" microtubule plus ends by associating with a site of β-tubulin engaged in longitudinal tubulin-tubulin interactions.
Herzklopfen erforscht
Neue Einblicke in die Funktionsweise wichtiger Arzneimittelrezeptoren: Viele Arzneimittel wirken auf bestimmte Rezeptoren ein, die in der Aussenhülle unserer Körperzellen sitzen. Einer dieser Rezeptoren ist der sogenannte Beta-1-Adrenorezeptor. Er ist unter anderem für das buchstäbliche Herzklopfen verantwortlich. Wie er Signale ins Zellinnere überträgt, liess sich nun im Detail aufklären. Dies wird helfen, die Wirkmechanismen vieler Arzneien deutlich besser zu verstehen.
Determining the structures of nanocrystalline pharmaceuticals by electron diffraction
A new type of detector developed by Dr. van Genderen enables the structure determination of pharmaceutical compounds with electron diffraction at room temperature. The group concentrate on expanding this new technique to macromolecular compounds.
Neue Details der Reizübertragung in Lebewesen aufgedeckt
Forschende decken neue Details darüber auf, wie die Zellen von Lebewesen Reize verarbeiten. Im Mittelpunkt stehen sogenannte G-Proteine, die helfen, Reize, die von aussen bei einer Zelle ankommen, ins Zellinnere weiterzuleiten. Die Studie zeigt erstmals, welcher Teil der G-Proteine für deren Funktion entscheidend ist . Von den Ergebnissen berichten Forschende des Paul Scherrer Instituts PSI, der ETH Zürich, des Pharmaunternehmens Roche und des britischen MRC Laboratory of Molecular Biology in der jüngsten Ausgabe des Fachmagazins Nature Structural and Molecular Biology.
Gemeinsam statt einsam
An SwissFEL und SLS Biomoleküle entschlüsseln: Proteine sind ein begehrtes, aber widerspenstiges Forschungsobjekt. Eine für Freie-Elektronen-Röntgenlaser wie dem zukünftigen SwissFEL des PSI entwickelte Methode soll ihre Erforschung nun ein grosses Stück vorantreiben. Dabei werden viele identische, kleine Proteinproben in kurzen Abständen hintereinander mit einem Röntgenstrahl durchleuchtet. Damit wird ein bisheriges Hauptproblem der Erforschung von Proteinen umgangen: Proben in ausreichender Grösse herzustellen.
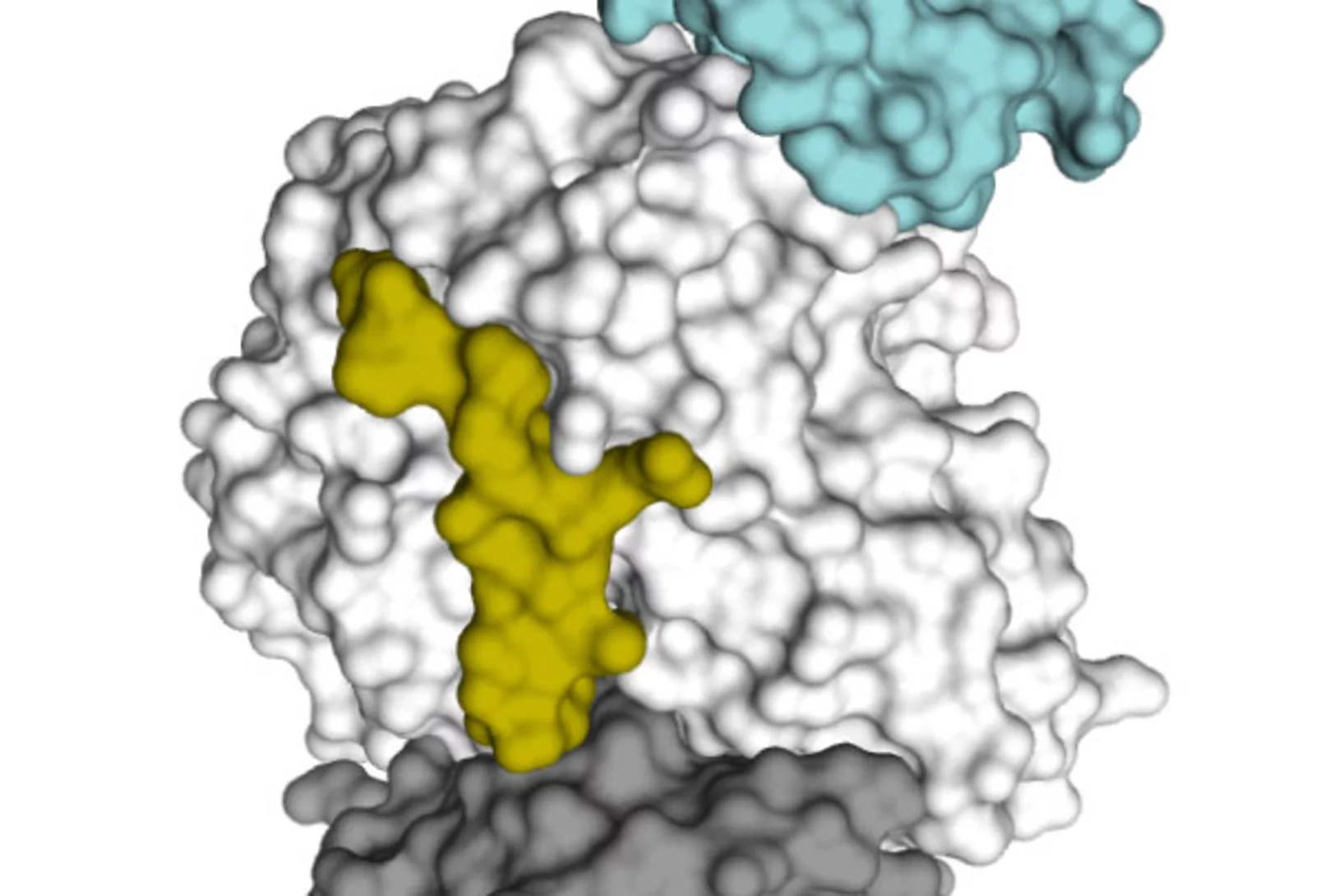
Wie Botox an Nervenzellen bindet
Botox ist ein hochgefährliches Gift, das Lähmungen verursacht. In der Kosmetik wird es zur zeitweiligen Beseitigung von Falten und in der Medizin etwa als Mittel gegen Migräne oder zur Korrektur von Strabismus (Schielen) eingesetzt. Ein Forschungsteam hat nun bestimmt, wie das Toxinmolekül an die Nervenzelle bindet, deren Aktivität vom Gift blockiert wird. Die Ergebnisse können nützlich für die Entwicklung verbesserter Medikamente sein, bei denen die Gefahr einer Überdosierung geringer ist als bisher.
Einblick in die Schaltzentralen der Zellkommunikation
Zahlreiche Prozesse in unserem Körper wie das Sehen, Riechen oder Schmecken werden durch eine wichtige Familie von Sensoren auf der Oberfläche von Zellen bewerkstelligt, die man G-Protein-gekoppelte Rezeptoren (GPCR) nennt. Forscher haben nun die bislang bekannten räumlichen Strukturen von GPC-Rezeptoren verglichen und ein stabilisierendes Gerüst von feinen Verstrebungen entdeckt, das charakteristisch ist für die Architektur der gesamten GPCR-Familie. Das Wissen um diese im Lauf der Evolution konservierten Baumerkmale kann für die Entwicklung neuer Medikamente von erheblichem Nutzen sein.
Wie stabilisierte Zellfasern Krebszellen am Teilen hindern
Die unter dem Schlagwort Chemotherapie verwendeten Krebsmedikamente hindern Zellen daran sich zu teilen. Da sich die Zellen in einem wachsenden Tumor häufiger teilen als andere, werden Tumorzellen besonders stark geschädigt. Forscher des Paul Scherrer Instituts und der ETH Zürich haben nun für eine Klasse solcher Medikamente den genauen Wirkmechanismus aufgeklärt. Die gewonnenen Informationen sind so exakt, dass man nun gezielt Medikamente entwickeln könnte, die noch besser an ihre Aufgabe angepasst sind.