Forschende des Paul Scherrer Instituts PSI haben einen wichtigen Teil eines Signalweges aufgeklärt, der Informationen durch die Zellmembran in das Innere einer Zelle überträgt. Dieser Signalweg ist für alle Säugetiere von großer Bedeutung, da er an verschiedenen wichtigen Lebensprozessen wie der Regulation des Herzschlags beteiligt ist. Drei Proteine übermitteln dabei die Informationen in das Zellinnere. Volodymyr Korkhov, Biochemiker am PSI, und seinem Team gelang es, eine Momentaufnahme des dritten Proteins, der sogenannten Adenylylzyklase, zu machen und ihre Struktur mit nahezu atomarer Auflösung zu bestimmen. Durch die Bestimmung der Struktur dieser Komponente entdeckten die Forscher, wie sie sich selbst regulieren kann. Ihre Ergebnisse veröffentlichen die Forscher nun in der Zeitschrift Science.
(Illustration: Paul Scherrer Institut/Markus Fischer)
Das Zellinnere aller lebenden Zellen wird durch Membranen von der Außenwelt getrennt. Diese Membranen halten die Zellen insgesamt intakt und schützen sie vor negativen Einflüssen. Sie wirken aber auch als Barriere für Vitalstoffe und Informationen. Aus diesem Grund enthalten Zellmembranen Mechanismen, die einen gezielten Zugang gewünschter Substanzen ermöglichen oder Informationen externer Signale in die Zelle übertragen.
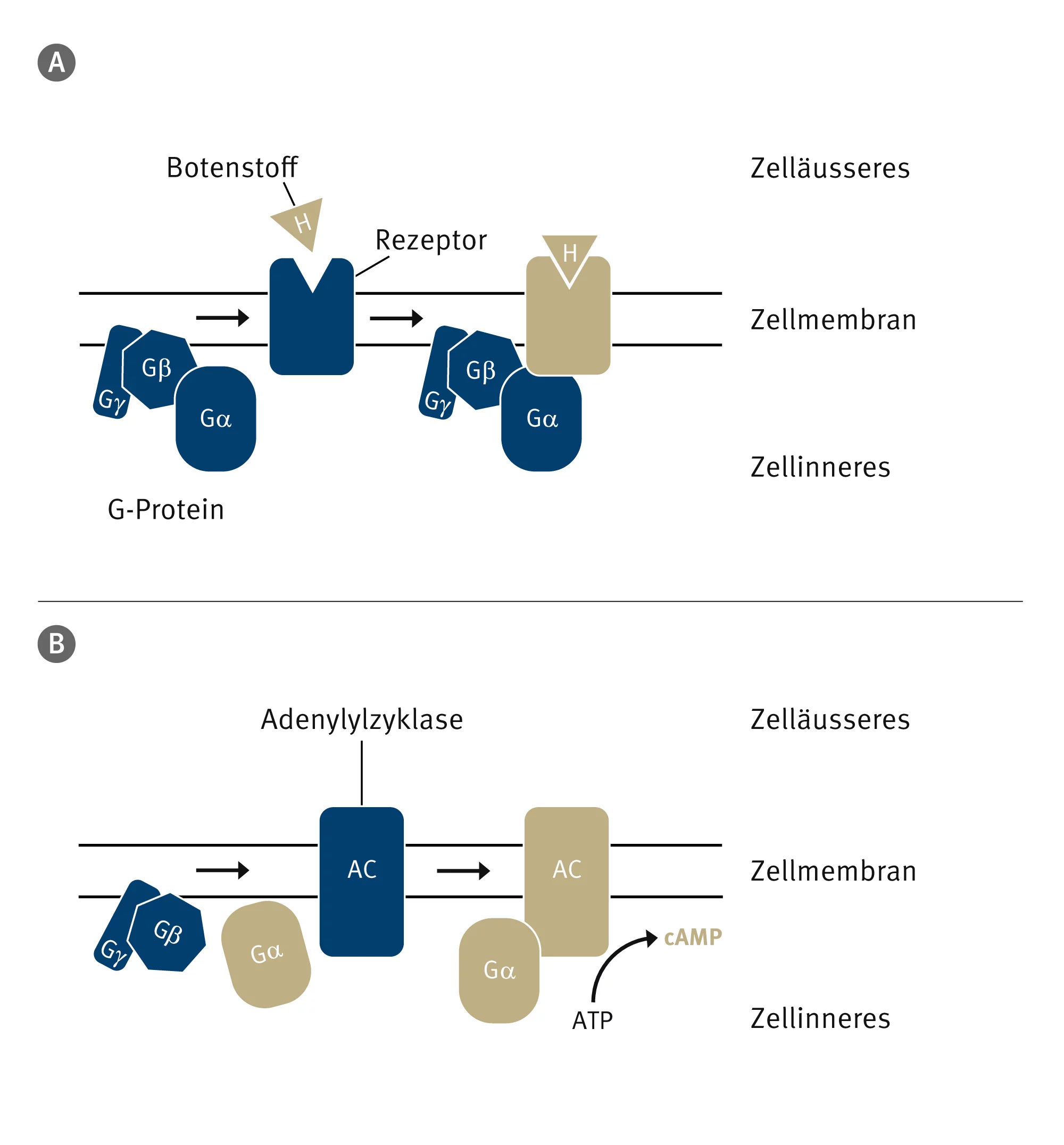
Ein wichtiger Signalweg bei Säugetieren besteht aus drei Komponenten: Erstens einem Rezeptor, der das Signal erkennt und dadurch aktiviert wird. Zweitens einem sogenannten G-Protein, das an den aktivierten Rezeptor bindet und das Signal an ein oder mehrere Effektorproteine weiterleitet. In diesem Fall ist der Effektor die Adenylylzyklase, die dritte Komponente der Signalkette. Dieses Protein wird durch eine Untereinheit des G-Proteins aktiviert und produziert in einer biochemischen Reaktion einen sekundären Botenstoff, das sogenannte zyklische AMP (cAMP).
cAMP löst verschiedene Reaktionen in der Zelle aus, zum Beispiel erhöht es die Durchlässigkeit der Membran für Kalzium in Herzzellen, was zu einer Steigerung der Herzschlagfrequenz führt.
Forschende des Paul Scherrer Instituts PSI in Villigen haben nun mithilfe der Elektronenmikroskopie eine spezielle Art dieser Adenylylzyklasen abgebildet und das bislang detailreichste Bild von dieser Art Membranprotein erhalten.
Hilfreiche Selbsthemmung
«Um zu verstehen, wie Signalwege in der Zelle funktionieren, ist es zunächst notwendig zu wissen, wie die beteiligten Komponenten im Detail aussehen», sagt Volodymyr Korkhov, Leiter der Forschungsgruppe Mechanismen der Signaltransduktion im Bereich Biologie und Chemie am PSI und Assistenzprofessor am Institut für Biochemie der ETH Zürich. «Unsere Arbeit ist ein wichtiger Beitrag zur Aufklärung der genauen Funktion der Adenylylzyklase in der cAMP-Signalkette.»
«Überraschenderweise haben wir durch die Bestimmung der Struktur der Adenylylzyklase, die an die Alpha-Untereinheit des G-Proteins gebunden ist, entdeckt, dass das Protein in der Lage zu sein scheint, sich selbst zu hemmen», sagt Biochemiker Korkhov. Ein Teil des Proteins ist für diese Selbsthemmung verantwortlich. Dieser Teil blockiert das aktive Zentrum des Enzyms und verhindert die Überproduktion von cAMP.
Die neue Erkenntnis zur Molekularstruktur der Adenylylzyklase liefert ein viel besseres Verständnis davon, wie externe Signale zur kontrollierten Produktion des wichtigen sekundären Botenstoffs cAMP führen. Die Konzentration von cAMP in Zellen spielt eine wichtige Rolle bei der Entstehung von Herz-Kreislauf-Erkrankungen, bestimmten Tumoren oder Typ-2-Diabetes. «In Zukunft könnten es unsere neuen Erkenntnisse ermöglichen, Medikamente zu identifizieren, die die Adenylylzyklase hemmen oder aktivieren – je nachdem, ob Überproduktion oder ein Mangel an cAMP für eine Krankheit verantwortlich ist», erklärt Korkhov.
Mikroskopie bei tiefen Temperaturen
Ihre Ergebnisse erzielten die Forscher mithilfe der Kryoelektronenmikroskopie (Kryo-EM). Diese Form der Transmissionselektronenmikroskopie verwendet Temperaturen unter -150 Grad Celsius. Die zu untersuchende Probe wird in flüssigem Ethan schockgefroren, wodurch die natürliche Struktur der Probe erhalten bleibt. Diese Methode wird zunehmend für die Untersuchung biologischer Strukturen eingesetzt und wurde 2017 mit dem Nobelpreis ausgezeichnet. «Es ist spannend, einen tiefen Einblick in die Struktur der Adenylylzyklase zu bekommen», sagt Chao Qi, Doktorand im Labor von Korkhov und Erstautor der Studie. «Die Struktur dieses Proteins war seit seiner Entdeckung jahrzehntelang schwer fassbar, und ich bin froh, dass ich diese Struktur mit Kryo-EM während meiner Doktorarbeit aufklären konnte.»
Die von den PSI-Forschern in ihren Untersuchungen erzielte Auflösung betrug 3,4 Ångström. Ein Ångström entspricht einem Zehnmillionstel eines Millimeters. Isolierte Atome haben einen Radius von 0,3 bis 3 Ångström.
Die Forscher veröffentlichen ihre Ergebnisse nun in der wissenschaftlichen Zeitschrift Science.
Text: Paul Scherrer Institut/Sebastian Jutzi
Über das PSI
Das Paul Scherrer Institut PSI entwickelt, baut und betreibt grosse und komplexe Forschungsanlagen und stellt sie der nationalen und internationalen Forschungsgemeinde zur Verfügung. Eigene Forschungsschwerpunkte sind Materie und Material, Energie und Umwelt sowie Mensch und Gesundheit. Die Ausbildung von jungen Menschen ist ein zentrales Anliegen des PSI. Deshalb sind etwa ein Viertel unserer Mitarbeitenden Postdoktorierende, Doktorierende oder Lernende. Insgesamt beschäftigt das PSI 2100 Mitarbeitende, das damit das grösste Forschungsinstitut der Schweiz ist. Das Jahresbudget beträgt rund CHF 390 Mio. Das PSI ist Teil des ETH-Bereichs, dem auch die ETH Zürich und die ETH Lausanne angehören sowie die Forschungsinstitute Eawag, Empa und WSL.
(Stand 05/2018)
Kontakt/Ansprechpartner
Prof. Dr. Volodymyr Korkhov
Forschungsgruppe Mechanismen der Signaltransduktion
Paul Scherrer Institut, Forschungsstrasse 111, 5232 Villigen PSI, Schweiz
Telefon: +41 56 310 28 42, E-Mail: volodymyr.korkhov@psi.ch [Englisch]
Originalveröffentlichung
The structure of a membrane adenylyl cyclase bound to an activated stimulatory G protein
Chao Qi, Simona Sorrentino, Ohad Medalia, Volodymyr M. Korkhov
Science 26.04.2019
DOI: 10.1126/science.aav0778