Neue Einblicke in die Funktionsweise wichtiger Arzneimittelrezeptoren
Um ihre heilende Wirkung zu entfalten, müssen Arzneimittel nicht unbedingt selber in unsere Körperzellen eindringen. Viele Medikamente wirken stattdessen auf bestimmte Rezeptoren in der Aussenhülle der Zellen ein. Diese Rezeptoren reichen bis ins Innere der Zelle hinein und setzen dort eine erwünschte Reaktion in Gang. Einer dieser Rezeptoren ist der sogenannte Beta-1-Adrenorezeptor. Er ist unter anderem für das buchstäbliche Herzklopfen verantwortlich, das wir beispielsweise bei Lampenfieber spüren – oder wenn wir verliebt sind. Am Beispiel dieses Beta-1-Adrenorezeptors haben nun Forschende des Paul Scherrer Instituts PSI gemeinsam mit Kollegen des Biozentrums der Universität Basel im Detail aufgeklärt, wie die Signalübertragung ins Zellinnere funktioniert. Ihre Ergebnisse lassen sich auf eine ganze Klasse ähnlicher Zellrezeptoren übertragen und helfen daher, die Wirkmechanismen vieler Arzneien deutlich besser zu verstehen. Die Methode könnte somit zukünftig zu verbesserten Medikamenten beitragen. Die aktuelle Studie wurde im Fachblatt Nature veröffentlicht.
Kaum auf die Türklingel gedrückt, schon entsteht Bewegung im Inneren des Hauses – ohne dass der Besucher selbst ins Haus eintreten muss. Ganz ähnlich wirken viele Medikamente, darunter Betablocker gegen Bluthochdruck und Arzneistoffe zur Behandlung von Allergien, Krebs, Parkinson oder HIV. Diese Arzneien binden an sogenannte Rezeptoren, die in der Aussenhülle unserer Körperzellen sitzen. Genau wie die Türklingel leiten die Rezeptoren daraufhin ein Signal ins Zellinnere, was dort wiederum zur erwünschten Wirkung führt.
Rezeptor für das Herzklopfen untersucht
Eine dieser Türklingeln
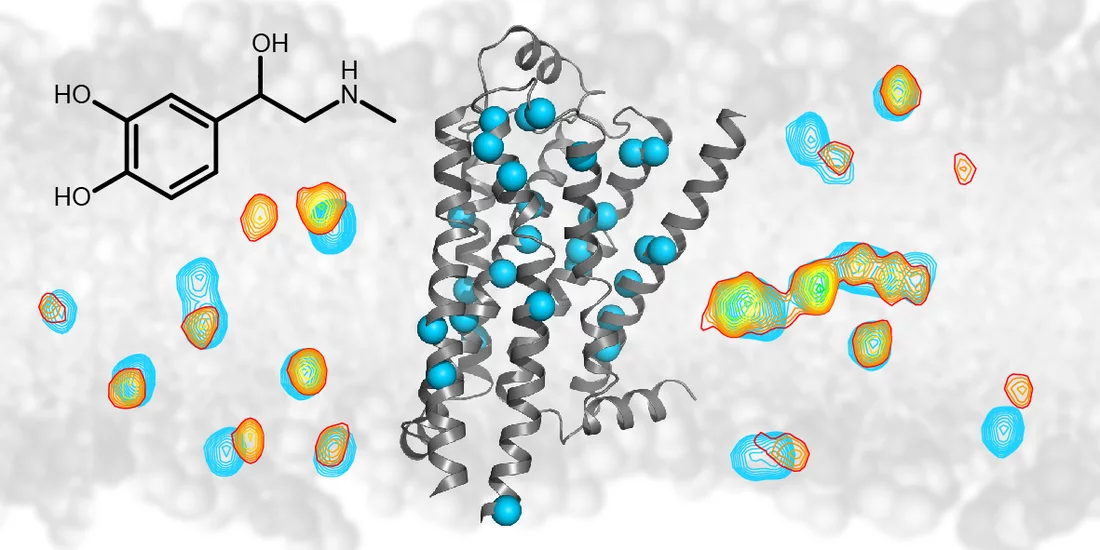
, den sogenannten Beta-1-Adrenorezeptor, hat ein gemeinsames Team von Forschenden am Biozentrum der Universität Basel und am Paul Scherrer Institut PSI nun genau untersucht. Mittels Messungen per Kernmagnetresonanzspektroskopie (NMR) konnten die Wissenschaftler verfolgen, wie die Struktur dieses Rezeptors auf verschiedene Wirkstoffe reagiert, wie also der Rezeptor seine Struktur verändert und dadurch ein bestimmtes Signal ins Zellinnere weiterleitet.
Der Beta-1-Adrenorezeptor ist unter anderem in der Aussenhülle von Herzzellen zu finden. Er wird beispielsweise durch das Hormon Noradrenalin aktiviert und löst dann eine Signalkaskade aus, die schliesslich zu einem Anstieg der Herzfrequenz und des Blutdrucks führt. Somit ist der Beta-1-Adrenorezeptor auch für das buchstäbliche Herzklopfen verantwortlich, das wir bei Lampenfieber oder Verliebtheit spüren.
Betablocker wirken dem entgegen, indem sie das Hormon daran hindern, an den Beta-1-Adrenorezeptor anzudocken. Die Forschenden haben nun genaue Details darüber ans Licht gebracht, wie die Bindung verschiedener Moleküle an den Beta-1-Adrenorezeptor dessen Struktur verändert und so seine Signalübertragung beeinflusst.
Ergebnisse lassen sich auf bedeutende Klasse von Arzneimittelrezeptoren übertragen
Der Beta-1-Adrenorezeptor gehört zur Familie der sogenannten G-Protein-gekoppelten Rezeptoren. Da diese allesamt vergleichbare Mechanismen haben, lassen sich die neuen Ergebnisse der Forschenden auf diese ganze Rezeptorfamilie übertragen. G-Protein-gekoppelte Rezeptoren wiederum sind für die Wirkweise von rund 30 Prozent aller neu zugelassenen Medikamente verantwortlich und daher von grosser Bedeutung in der Medizin.
Nur das kombinierte Expertenwissen der Forschenden am PSI und am Biozentrum Basel hat dieses Forschungsergebnis möglich gemacht
, sind sich Dmitry Veprintsev und Gebhard Schertler vom PSI einig. Ihr Team hat jahrelange Erfahrung in der Forschung mit G-Protein-gekoppelten Rezeptoren. So entwickelten sie eine stabilisierte Version des Beta-1-Adrenorezeptors, was die hohe Qualität der NMR-Messungen ermöglichte, die am Biozentrum Basel stattfanden.
Wir haben mittels hochauflösender NMR-Spektroskopie die strukturellen Veränderungen des Beta-1-Adrenorezeptors nach Bindung verschiedener Wirkstoffe analysiert
, erklärt Shin Isogai vom Biozentrum Basel und Erstautor der Studie. So konnten wir beobachten, wie der Rezeptor seinen Bindungspartner erkennt, dessen chemische Struktur interpretiert und durch die Änderung seiner eigenen Struktur diese Information anschliessend ins Zellinnere weiterleitet.
NMR-Methode könnte zur Entwicklung neuer Arzneimittel eingesetzt werden
Mit ihrer NMR-Methode konnten die Forschenden nachverfolgen, wie sich die Struktur des Rezeptors änderte. So konnten sie feststellen, wie tief ein Wirkstoff in den Rezeptor eindrang, wie er dabei einzelne Proteinteile beiseiteschob und wie dieses mechanische Signal ins Zellinnere übertragen wurde. Dadurch konnten sie wichtige mechanische Verknüpfungen innerhalb der Rezeptorstruktur identifizieren, die für die Signalübertragung eine Rolle spielen. Aus den NMR-Daten ergab sich auch ein direktes Mass für die Bindungsstärke der verschiedenen Wirkstoffe und für ihr Potenzial, in der Zelle eine Antwort auszulösen. Eine solche Antwort, die der Bindung eines intrazellulären Signalproteins an den aktivierten Rezeptor entsprang, konnten die Forschenden sogar direkt verfolgen.
Da diese Rezeptoren extrem schwierig zu untersuchen sind, freut es uns umso mehr, dass wir nun erstmals solche Einzelheiten aufdecken konnten. Viele Wissenschaftler treibt das schon mehr als ein Jahrzehnt um
, betont Isogai. Wir werden die Technik nun zur Erforschung der Rolle einzelner Aminosäuren in der Signalübertragung sowie anderer Rezeptoren verwenden.
Zukünftig könnte die NMR-Methode auch bei Entwicklungen und Tests neuer Arzneimittel zum Einsatz kommen.
Text: Paul Scherrer Institut/Laura Hennemann;
Text auf Grundlage einer Medienmitteilung der Universität Basel
Über das PSI
Das Paul Scherrer Institut PSI entwickelt, baut und betreibt grosse und komplexe Forschungsanlagen und stellt sie der nationalen und internationalen Forschungsgemeinde zur Verfügung. Eigene Forschungsschwerpunkte sind Materie und Material, Energie und Umwelt sowie Mensch und Gesundheit. Die Ausbildung von jungen Menschen ist ein zentrales Anliegen des PSI. Deshalb sind etwa ein Viertel unserer Mitarbeitenden Postdoktorierende, Doktorierende oder Lernende. Insgesamt beschäftigt das PSI 1900 Mitarbeitende, das damit das grösste Forschungsinstitut der Schweiz ist. Das Jahresbudget beträgt rund CHF 380 Mio.
(Stand 04/2015)
Kontakt / Ansprechpartner
Dr. Dmitry Veprintsev, Projektleiter, Labor für Biomolekulare Forschung,Paul Scherrer Institut
Telefon: +41 56 310 52 46, E-Mail: dmitry.veprintsev@psi.ch [Englisch]
Dr. Gregor Cicchetti, Scientific Relations Manager, Bereich für Biologie und Chemie,
Paul Scherrer Institut
Telefon: +41 56 310 53 82, E-Mail: gregor.cicchetti@psi.ch [Deutsch, Englisch]
Prof. Gebhard Schertler, Bereichsleiter, Bereich für Biologie und Chemie am Paul Scherrer Institut,
Professor für Strukturbiologie an der ETH Zürich
Telefon: +41 56 310 42 65, E-Mail: gebhard.schertler@psi.ch [Deutsch, Englisch]
Originalveröffentlichung
Backbone NMR reveals allosteric signal transduction networks in the β1-adrenergic receptorS. Isogai, X. Deupi, C. Opitz, F.M. Heydenreich, F. Brueckner, G.F.X. Schertler,
D.B. Veprintsev and S. Grzesiek
Nature 3. Februar 2016 (online)
DOI: 10.1038/nature16577