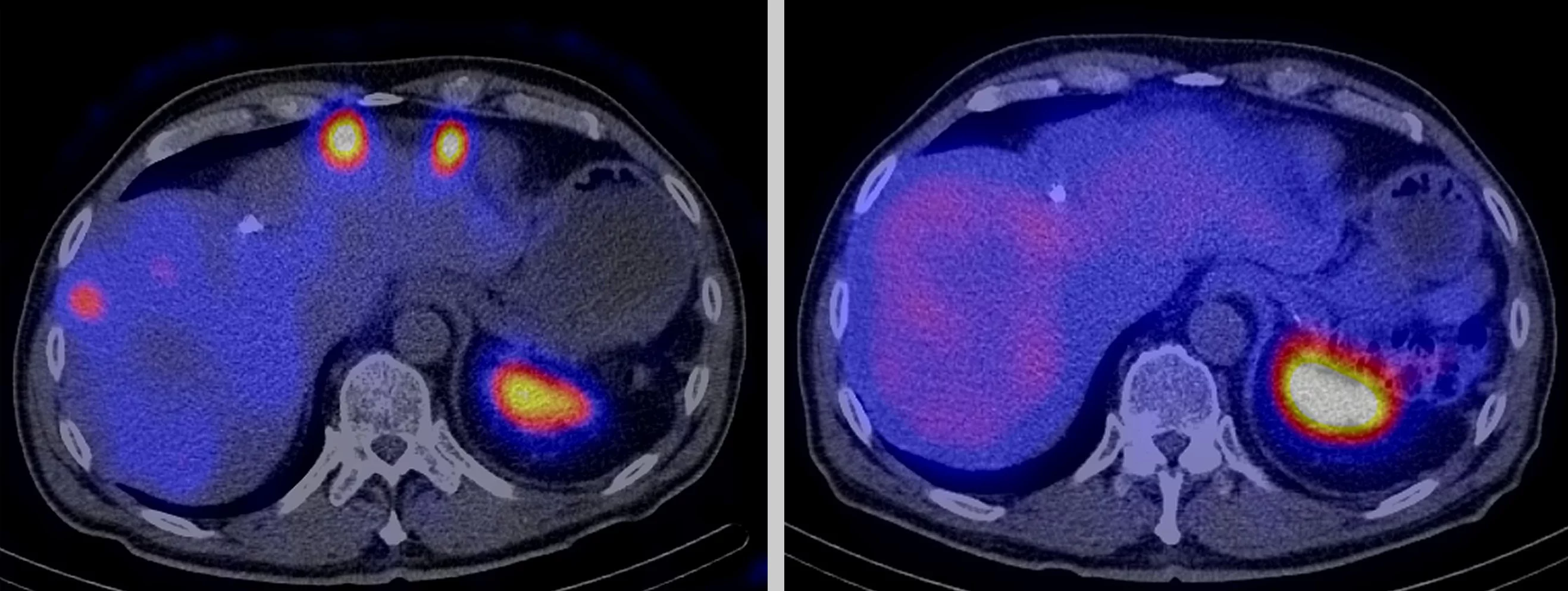
Il existe des tumeurs contre lesquelles, apparemment, rien ne marche: ni la chimiothérapie, ni la radiothérapie externe, ni la chirurgie. Souvent, elles ont déjà formé des métastases et ne peuvent plus être éliminées par des méthodes conventionnelles. La seule issue qui reste alors, c’est la radiothérapie interne avec des substances radioactives ciblées, que l’on introduit directement dans la tumeur. Vingt chercheurs spécialisés œuvrent dans ce but au Centre des sciences radiopharmaceutiques à l’Institut Paul Scherrer PSI, une institution commune du PSI, de l’EPF Zurich et de l’Hôpital universitaire de Zurich.
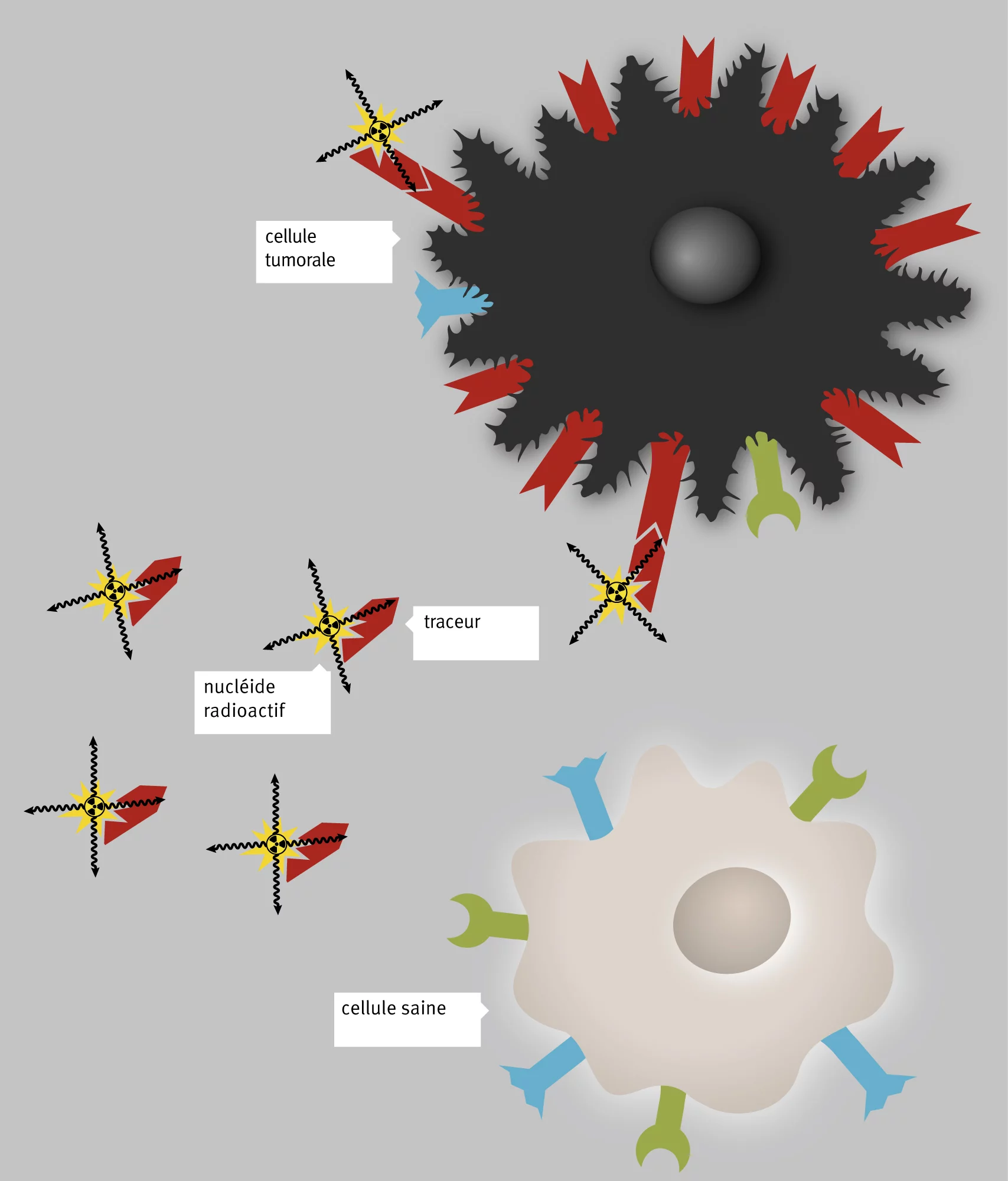
La radioactivité ne se voit pas, elle n’a pas d’odeur et on ne la sent pas. De fait, beaucoup de gens ont peur de cette énergie invisible, pour eux, elle évoque les centrales nucléaires et Fukushima. Pourtant, elle permet aux médecins de détecter et d’éliminer des tumeurs et des cellules cancéreuses dispersées. Pour ce faire, ces derniers utilisent ce qu’on appelle des radiopharmaceutiques: des médicaments radioactifs, que l’on dote de certaines propriétés physiques et chimiques, en fonction du type de cellule tumorale et de l’application. Les scientifiques exploitent la présence à la surface des tumeurs de certaines structures spéciales, auxquelles les radiopharmaceutiques peuvent s’arrimer à condition de contenir une molécule adéquate.
Tout médicalement radioactif est composé d’une molécule de ce genre précisément ajustée, appelée traceur, et d’un isotope radioactif qui émet un rayonnement. Ces substances cherchent d’elles-mêmes leur cible dans l’organisme, explique Christof Rottenburger, spécialiste de médecine nucléaire à l’Université de Bâle et partenaire de projet du PSI. Elles relâchent la radiation sur place et, en général, elles ne provoquent que peu d’effets indésirables.
Par rapport à la chimiothérapie, cela représente un avantage pour les patients et cela permet de traiter aussi de manière efficace et ciblée les tumeurs qui ont déjà beaucoup métastasé dans l’organisme, ce qui les rends inopérables et impossibles à traiter par radiothérapie externe.
En étroite collaboration avec des cliniques
Avec notre recherche, nous intervenons là où, aujourd’hui, les médecins n’ont pas de possibilités de traitement
, souligne Roger Schibli, directeur du Centre de sciences radiopharmaceutiques (ZRW), une entreprise commune du PSI, de l’EPF Zurich et de l’Hôpital universitaire de Zurich. Aux yeux de ce chercheur, la collaboration avec des médecins est essentielle, car ce sont eux qui savent le mieux quelles sont les maladies pour lesquelles les procédures de médecine nucléaire sont utiles. Les chercheurs du ZRW, eux, s’occupent de la recherche du comment
et du par quel biais
. Rien qu’au PSI, cinq groupes de travail s’efforcent de développer les meilleurs radiopharmaceutiques pour différents types de cancer et pour d’autres maladies. Ces produits doivent être rapidement absorbés par l’organisme, se lier de manière spécifique aux cellules recherchées et quitter rapidement les autres tissus afin de ne pas y infliger de dégâts. Par ailleurs, il faut que leur demi-vie soit assez longue pour assurer un examen ou un traitement suffisant, et émettre des radiations susceptibles d’être bien captées par les caméras des appareils d’examen. Il n’existe pas de radiopharmaceutique idéal qui fonctionne tout aussi bien pour toutes les applications, souligne Roger Schibli. On distingue en effet entre les médicaments radioactifs à usage diagnostique et ceux qui sont utilisés à des fins thérapeutiques.
Entre ces deux catégories, les différences sont plus importantes que les points communs. Pour les questions de diagnostic, les chercheurs sont en quête de radiopharmaceutiques, dont le rayonnement présente une portée suffisante pour qu’on puisse mesurer la répartition de la substance dans l’organisme au moyen d’appareils ultrasensibles et la visualiser par imagerie. Les isotopes qui émettent un rayonnement de positons ou un rayonnement gamma se prêtent particulièrement bien à cette utilisation. Mais si un médicament radioactif est destiné à des fins thérapeutiques, ce qui compte, c’est que le rayonnement reste à l’intérieur de la zone cible dans l’organisme et émette beaucoup d’énergie sur une distance de l’ordre du millimètre, ce qui permet de détruire la tumeur. Les radiopharmaceutiques qui se prêtent le mieux à de telles applications sont ceux qui émettent un rayonnement de particules, c’est-à-dire surtout un rayonnement béta moins ou un rayonnement alpha.
Plus que de la physique
Le chemin qui mène de l’origine physique d’un radiopharmaceutique à son efficacité médicale optimale est long, il dure des années et inclut souvent le travail des cinq groupes de recherche du PSI. Le défi dans notre travail, c’est l’interdisciplinarité, souligne Martin Béhé, chef du groupe de recherche Pharmacologie au ZRW. Pour atteindre nos objectifs, nous devons prendre en compte des aspects biologiques, chimiques, médicaux, pharmaceutiques et physiques. Chacun doit comprendre de quoi il retourne dans son propre domaine de spécialité, mais aussi dans les autres domaines. C’est parfois difficile, mais fascinant.
Son groupe de recherche étudie surtout des peptides, de petites protéines qui sont aussi présentes dans les organismes en bonne santé. Les chercheurs modifient les composants de ces molécules ou leur structure, afin de pouvoir leur attacher un isotope radioactif qui achemine directement son rayonnement jusqu’aux cellules cancéreuses choisies. Cela nécessite des connaissances particulières. D’un côté, nous devons savoir de quelles cellules est composée la tumeur, connaître son développement et les symptômes qu’elle provoque, poursuit Martin Béhé. Mais de l’autre, nous devons aussi connaître le comportement de la substance avec laquelle nous cherchons à diagnostiquer ou à combattre la tumeur une fois qu’elle est dans l’organisme, sans oublier les voies métaboliques qu’elle emprunte. Nous devons enfin savoir à quel point et à quelle rapidité elle est absorbée par les reins et de nouveau excrétée.
Hormis son groupe, il existe encore une deuxième équipe: les spécialistes qui la composent effectuent des recherches ciblées, afin de trouver de nouvelles substances actives pour les coupler à des molécules radioactives. Le groupe Chimie de nucléide utilise surtout l’acide folique, une vitamine dont les cellules cancéreuses ont besoin pour proliférer. Il existe de nombreux types de tumeurs qui portent à leur surface des récepteur des folates, auxquels peut s’arrimer une clé chimique correspondante. Cela fait d’eux des cibles d’attaque parfaites pour des molécules d’acide folique marquées radioactivement.
Production étroitement surveillée
Lorsqu’un des deux groupes a développé un radiopharmaceutique utilisable une première fois sur l’être humain, il se passe encore des mois, voire des années, jusqu’à ce dernier puisse être administré au patient. D’abord, les chercheurs doivent prouver que la nouvelle substance est aussi un médicament sûr. Cette tâche incombe au groupe de travail Suivi clinique du ZRW, dont le domaine de spécialité est d’un côté la production ultrastérile, standardisée et donc reproductible de radiopharmaceutiques, conformément aux directives de bonne pratique de fabrication (good manufacturing practice). D’un autre côté, ce groupe inclut aussi des collaborateurs spécialisés dans la préparation des documents complexes exigés pour les études cliniques par Swissmedic, l’autorité suisse de contrôle et d’autorisation des produits thérapeutiques, avant l’homologation d’un nouveau radiopharmaceutique.
Il ne s’agit pas seulement de décrire précisément la molécule traceuse, mais aussi l’isotope radioactif qui lui est attaché. Il existe une centaine d’isotopes susceptibles d’entre en ligne de compte pour une utilisation sur l’être humain, mais seuls quelques-uns peuvent être fabriqués en quantités suffisantes et avec le degré de pureté nécessaire. D’abord, nous devons trouver un matériau de départ, susceptible de fournir la radioactivité désirée, explique Roger Schibli. Ensuite, nous devons réfléchir au moyen de séparer l’isotope effectif du matériau de départ, mais aussi à ce qui arrive à ses sous-produits.
Deux groupes de travail assurent ces étapes: le groupe Développement des radionucléides, qui fait partie du Laboratoire de radiochimie du PSI, et le groupe Production du nucléide et maintenance. Les chercheurs de ces deux équipes sont ceux qui influencent le plus la partie radioactive d’une substance active, qui améliorent son processus de fabrication et qui recherchent de nouveaux isotopes. Grâce à l’infrastructure unique au PSI, notamment nos accélérateurs et nos sources de neutrons, nous avons aussi la possibilité d’étudier des isotopes qui ne peuvent être produits qu’ici, souligne encore Roger Schibli. Cela nous ouvre la possibilité de développer des substances constamment améliorées, qui aideront un jour les patients.
Même si les médicaments radioactifs développés au ZRW ne sont pas encore homologués pour l’utilisation dans le quotidien clinique, le centre joue un rôle pionnier au niveau du développement. Ses radiopharmaceutiques sont des prototypes sur lesquels toutes les propriétés importantes ont été testées, y compris la production standardisée. Les résultats de ce travail peuvent servir de référence aux entreprises et aux autorités lorsque de nouveaux radiopharmaceutiques sont homologués ou en cas d’utilisation de nouvelles technologies.
Texte: Sabine Goldhahn
Informations supplémentaires
- Un aperçu sur le développement et la production d’un médicament particulier au Centre des sciences radiopharmaceutiques proposent les articles:
Développement d'un nouveau médicament contre le cancer de la thyroïde
etDes médicaments fabriqués avec la plus haute précision
. - Une nouvelle méthode pour introduire des substances radioactives dans le noyau cellulaire est décrite dans l’article:
Frapper le cancer en plein cœur
. - L’article décrit comment les chercheurs du PSI développent des procédés efficaces pour produire des radionucléides destinés au diagnostic médical:
Nucléide spécialement conçu pour des applications médicales
. - Comment les chercheurs du PSI produisent des radionucléides:
Dans la ligne de mire des protons
.
Contact
Prof. Roger Schibli, directeur du Centre des sciences radiopharmaceutiquesde l’Institut Paul Scherrer PSI, de l’EPF Zurich et de l’Hôpital universitaire de Zurich
Téléphone: +41 56 310 28 37, e-mail: roger.schibli@psi.ch