Des chercheurs de l’Institut Paul Scherrer PSI ont développé une substance active qui permet de cibler et traiter une forme particulièrement maligne du cancer de la thyroïde. Ils utilisent une protéine apparentée à la gastrine, une hormone produite par l’organisme, et la dotent d’une substance radioactive. Ce composé, le radiotraceur, est capable de s’arrimer à certains récepteurs situés à la surface des cellules tumorales comme une clé dans une serrure. La radiation émise par le radiotraceur peut alors détruire la tumeur, tout en ménageant les tissus environnant, grâce à la courte portée de son rayonnement. Le nouveau médicament a un avantage: il permet de traiter une certaine forme de cancer de la thyroïde où le traitement à l’iode radioactif est inefficace. Les chercheurs du PSI ont développé le radiotraceur à un stade suffisamment avancé pour qu’une première étude puisse être menée sur des patients à l’Hôpital universitaire de Bâle.
Le cancer médullaire de la thyroïde (CMT) est la troisième forme de cancer la plus fréquente à affecter la thyroïde. Plutôt rare, il représente seulement 10% des carcinomes thyroïdiens, mais fait partie des formes particulièrement agressives, car il produit facilement des métastases. Un quart de ces cancers sont transmis de manière héréditaire, si bien que parfois le CMT touche déjà des enfants ou de jeunes adultes. Les premiers signes de la maladie sont un nodule au cou et des difficultés à avaler, puis viennent l’enrouement et des problèmes respiratoires. Si le cancer est découvert à un stade précoce, le patient peut être soigné moyennant une ablation chirurgicale complète de la glande thyroïde suivie d’une chimiothérapie. «Mais si la tumeur a formé des métastases, une guérison est pratiquement exclue», explique Martin Béhé du Centre des sciences radiopharmaceutiques à l’Institut Paul Scherrer PSI. Le patient peut survivre entre huit et quinze ans, mais la qualité de vie du patient est souvent entravée par les effets secondaires de la tumeur et de ses métastases, telles qu’hypertension artérielle et de violentes diarrhées. Ces effets provenant de la sécrétion d’hormones par la tumeur et par ses métastases.
La raison de cette production d’hormones réside dans le type des cellules tumorales. Contrairement aux formes les plus fréquentes de cancer de la thyroïde, le CMT ne se développe pas dans le tissu typique qui stocke l’iode dans la thyroïde; c’est pour cela qu’il n’est pas possible de le combattre avec un traitement à l’iode radioactif. Il se développe aux dépens de ce qu’on appelle les cellules C. Situées dans le tissu conjonctif de la glande thyroïde, ces cellules sécrètent une hormone appelée calcitonine qui joue un rôle dans le métabolisme phosphocalcique. A la surface, les cellules C portent une molécule qui est absente des cellules thyroïdiennes normales: le récepteur de la cholécystokinine de type 2 (CCK2). C’est là que se lient certaines hormones produites par l’organisme, entre autres la cholécystokinine et la gastrine. Dans environ 92% des cancers médullaires de la thyroïde, ces récepteurs CCK2 (la serrure) sont particulièrement nombreux. Cela fait de ces récepteurs un point d’attaque idéal pour un traitement ciblé, à condition de trouver une substance qui présente une structure chimique (la clé) similaire à la gastrine qui elle se lie aux récepteurs CCK2. «Il est possible de coupler une molécule spécifique de ce genre avec une substance radioactive appropriée qui va permettre d’acheminer directement la radioactivité jusqu’aux cellules cancéreuses», poursuit Martin Béhé. Le médicament (radiopharmaceutique ou radiotraceur) peut s’arrimer et détruire les cellules cancéreuses à l’aide de radiation (rayonnement β).
Des travaux qui ont bénéficié d’un financement de l’UE
Martin Béhé et d’autres scientifiques européens ont testé douze radiotraceurs susceptibles de cibler et détruire les cellules cancéreuses. Des travaux qu’ils ont menés dans le cadre de l’initiative COST (Coopération Européenne en Science et Technologie) cofinancée par l’Union européenne. L’objectif était de découvrir une substance se liant au récepteur CCK2, détruisant un nombre particulièrement élevé de cellules tumorales et provoquant le moins d’effets indésirables possible. Au terme d’une recherche de plusieurs années, Martin Béhé et son groupe du PSI ont fini par réussir: ils ont combiné une molécule plus petite que la gastrine, la minigastrine (PSIG-2), et un nucléide radioactif, le lutécium-177. Le nouveau radiotraceur ou également nommé radiopharmaceutique est baptisé «177LU-PSIG-2».
Une petite modification qui a un effet important
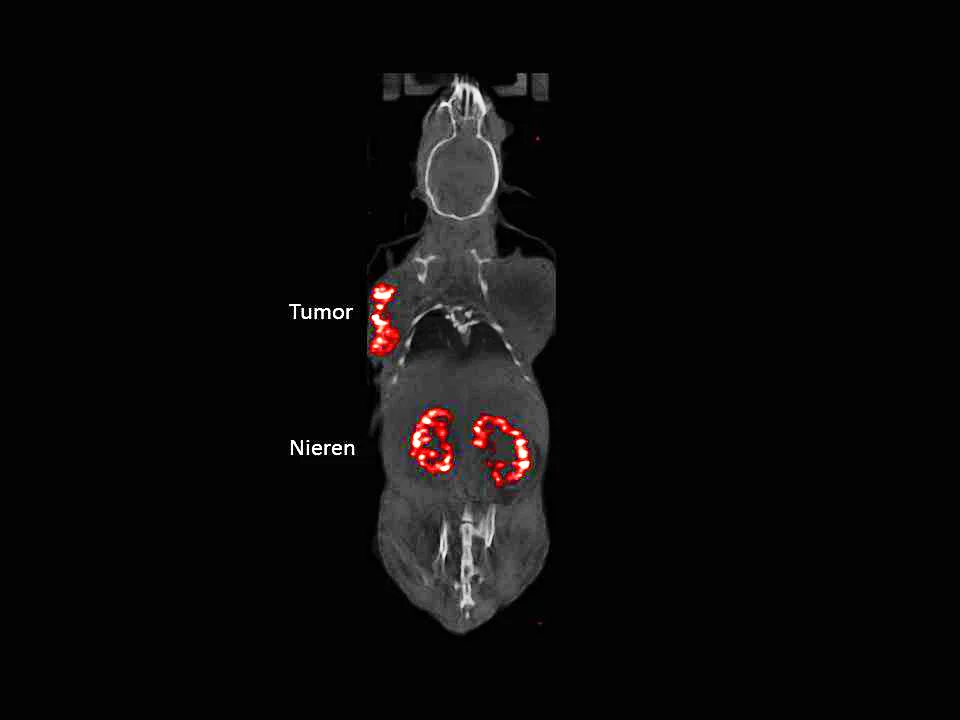
La voie qui a conduit au radiotraceur 177LU-PSIG-2 a été tout sauf simple. Les chercheurs ont d’abord mené des expériences avec un dérivé de la gastrine qui s’arrimait bien au récepteur CCK2. Les premiers résultats étaient prometteurs: dans le cadre des essais sur les animaux comme lors d’un premier essai sur patient, le cancer médullaire de la thyroïde avait beaucoup reculé. Mais cette nouvelle préparation ne s’accumulait pas seulement dans les cellules cancéreuses, elle s’accumulait aussi dans les reins. La substance y restait plus longtemps que ce que l’on souhaitait et elle pouvait endommager les tissus. Le nouveau produit a donc dû être écarté. Il fallait d’abord que les scientifiques trouvent la raison de cette importante accumulation dans les reins.
Lors de leur recherche, ils ont découvert qu’elle était due à certains acides aminés – les acides glutamiques, dont sont composés de nombreuses hormones et protéines. C’est grâce à six acides glutamiques présents dans la structure de la préparation, que la substance est facilement absorbée par les reins. Il fallait donc réduire le nombre de ces composants afin de bloquer l’absorption. Mais le résultat espéré n’a pas été au rendez-vous. Moins la molécule comptait d’acides glutamiques, plus elle était vulnérable à l’attaque d’enzymes produites par l’organisme, ce qui la rendait inutilisable. Il fallait donc que les six acides glutamiques restent dans la molécule. Pour empêcher l’importante accumulation du radiotraceur dans les reins, les chercheurs ont recouru à une autre astuce. Ils ont remplacé les acides glutamiques naturels par leurs équivalents artificiels. Les enzymes produites par l’organisme ne les identifient pas; de ce fait, ils ne peuvent pas être détruits et leur absorption par les reins reste faible.
Les scientifiques tirent parti du rayonnement bêta et gamma
Pour finir, Martin Béhé et son équipe devaient résoudre un autre problème: la minagastrine PSIG-2 contenait encore un autre acide aminé appelé méthionine. Cet acide aminé est susceptible de subir des modifications chimiques telles que le dérivé de la gastrine ne puisse plus se lier correctement au récepteur CCK2. Les chercheurs ont alors remplacé la méthionine par un acide aminé stable, la norleucine. Cette étape a marqué l’achèvement du développement du vecteur PSIG-2, au bout de dix ans de travaux. Ce qui a suivi relevait de la routine pour les experts du PSI et a duré trois ans: ils devaient encore choisir le nucléide radioactif adéquat pour former le radiotraceur, un composé de minigastrine et du nucléide. Leur choix s’est porté sur le lutécium-177, qui émet aussi bien du rayonnement bêta que du rayonnement gamma. Une fois que le médicament a ciblé les cellules tumorales, la radiation ne progresse que de quelques millimètres et lorsque le radiotraceur est arrimé aux cellules cancéreuses, il peut détruire directement la tumeur sans endommager le tissu environnant. Le rayonnement gamma, lui, traverse les différents tissus humains et peut être capté par une gamma-caméra. Cette caméra permet de produire une image et de visualiser l’accumulation du radiotraceur dans l’organisme et surtout dans la tumeur et ses métastases. Il est ainsi possible de suivre l’évolution de la propagation du cancer médullaire de la thyroïde par imagerie. «Ici, au PSI, nous avons développé le nouveau radiotraceur à un stade suffisamment avancé pour pouvoir le produire de manière standardisée, conformément aux règlementations pharmaceutiques. Nous avons déposé une demande d’autorisation auprès de Swissmedic, l’autorité suisse de contrôle des produits thérapeutiques, pour une étude clinique», se réjouit Martin Béhé.
Dès que le radiopharmaceutique 177LU-PSIG-2 sera autorisé pour des essais cliniques, les médecins de la clinique de médecine nucléaire de l’Université de Bâle pourront tester l’efficacité du nouveau radiotraceur sur des patients. Cette étude sur le cancer médullaire de la thyroïde à un stade avancé a déjà reçu l’autorisation de la commission d’éthique et bénéficie du soutien de la Ligue suisse contre le cancer.
Texte: Sabine Goldhahn
Informations supplémentaires
- Un aperçu sur le développement d’un médicament particulier au Centre des sciences radiopharmaceutiques propose l'article:
Des médicaments fabriqués avec la plus haute précision
. - Un aperçu du travail du Centre des sciences radiopharmaceutiques propose l'article:
Attaquer le cancer de manière ciblée
. - Une nouvelle méthode pour introduire des substances radioactives dans le noyau cellulaire est décrite dans l’article:
Frapper le cancer en plein cœur
. - L’article décrit comment les chercheurs du PSI développent des procédés efficaces pour produire des radionucléides destinés au diagnostic médical:
Nucléide spécialement conçu pour des applications médicales
. - Comment les chercheurs du PSI produisent des radionucléides:
Dans la ligne de mire des protons
.
Contact
Dr Martin Béhé, directeur du groupe Pharmacologie au Centre des sciences radiopharmaceutiquesde l’Institut Paul Scherrer PSI, de l’ETH Zurich et de l’Hôpital universitaire de Zurich
Téléphone: +41 56 310 28 17, e-mail: martin.behe@psi.ch