La plupart des cellules cancéreuses portent à leur surface des récepteurs qui leur confèrent leur caractère unique. Comme ces récepteurs se prolongent jusqu’à l’intérieur de la cellule, ils agissent en intermédiaires entre l’extérieur et l’intérieur. Les médicaments de chimiothérapie qui s’arriment à l’extérieur de la cellule déclenchent une cascade de réactions chimiques à l’intérieur. Objectif visé au terme de ce processus: la mort des cellules cancéreuses. Des chercheurs à l’Institut Paul Scherrer PSI étudient à présent une nouvelle méthode pour introduire des substances radioactives dans le noyau cellulaire, au lieu de les faire seulement adhérer à l’extérieur de la cellule. La source de rayonnement reste ainsi confinée à l’intérieur de la cellule et agit de manière plus ciblée, car elle se retrouve plus près du matériel génétique. Si l’on trouve les bons composés radioactifs, ce principe d’action pourrait s’avérer utile dans la lutte contre plusieurs types de cancer.
L’un des principaux objectifs du traitement contre le cancer est de frapper les cellules malignes en plein cœur, autrement dit dans leur noyau cellulaire. C’est de là que part tout le processus de croissance cellulaire excessive à l’origine de la prolifération dans l’organisme, car c’est là que se trouve l’ADN (information génétique). Dans le cas des cellules cancéreuses, l’ADN a subi une altération pathologique qui entraîne une division cellulaire plus rapide et plus fréquente que celle des cellules normales. De nombreuses cytotoxines utilisées dans le traitement de maladies cancéreuses par chimiothérapie atteignent le noyau cellulaire et interviennent précisément dans ces processus qui sont importants pour la division cellulaire. Alors que d’autres perturbent le métabolisme des cellules tumorales pour inhiber leur croissance. Les cytotoxines agissent donc toutes à l’intérieur de la cellule et tout particulièrement quand elle se divise. Cependant, nombre de cytotoxines ne sont pas spécifiques et attaquent aussi les tissus de l’organisme qui se renouvellent fréquemment, comme les cheveux et les muqueuses. Lors de radiothérapies conventionnelles également, où l’on irradie depuis l’extérieur, les cellules saines peuvent être endommagées. Car le rayonnement ionisant affecte aussi toutes les cellules qui se trouvent dans la zone irradiée.
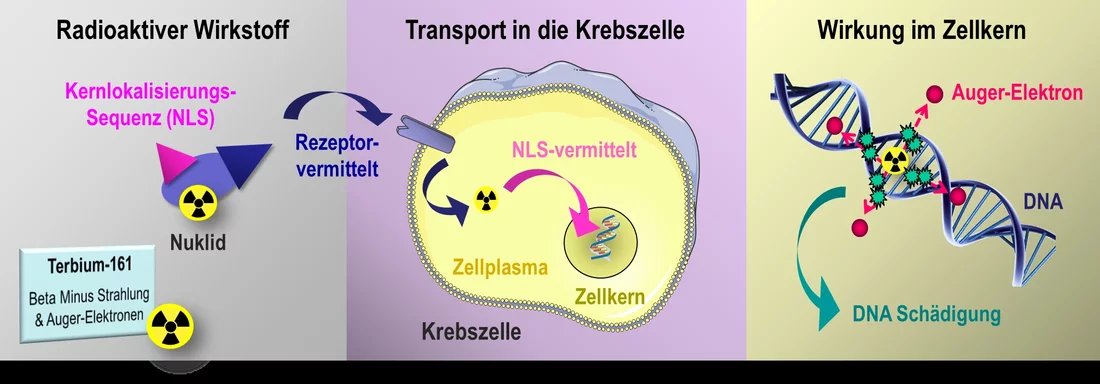
A l’inverse, les médicaments radiopharmaceutiques que l’on injecte dans la circulation sanguine du patient sont très spécifiques. Ils sont composés d’un complexe de plusieurs molécules, parmi lesquelles figurent le plus souvent un peptide et un atome de métal radioactif. Le peptide permet aux radiopharmaceutiques de s’arrimer aux récepteurs correspondants situés sur la membrane externe de la cellule tumorale. Soit le nucléide qui lui est couplé – la partie radioactive du médicament – adhère au récepteur à l’extérieur et reste là, soit il est acheminé par le récepteur jusqu’au plasma cellulaire. Pendant que le nucléide se désintègre, il émet un rayonnement dont la portée est de quelques millimètres seulement. Il pénètre ainsi l’intérieur de la cellule et le noyau cellulaire, en atteignant également des cellules voisines. Toutefois, le nucléide proprement dit n’atteint pas l’intérieur du noyau cellulaire. Ce dernier est entouré d’une membrane nucléaire protectrice qui empêche le nucléide de pénétrer à l’intérieur.
Deux voies qui mènent au but
Cristina Müller, pharmacienne du Centre des sciences radiopharmaceutiques (ZRW) au PSI étudie avec son équipe une possibilité d’améliorer encore l’effet des nucléides radioactifs directement dans le noyau cellulaire. Un objectif qu’elle atteint de deux façons: d’un côté, elle utilise un nouveau nucléide qui n’a encore jamais été utilisé chez des patients, de l’autre elle couple la substance radioactive à un peptide supplémentaire, un SLN (signal de localisation nucléaire). Ce SLN est capable de franchir la membrane nucléaire en se liant à des molécules de transport et d’introduire n’importe quelles substances dans le noyau cellulaire.
Pour ses études, Cristina Müller utilise un nucléide de terbium. Cet élément est un métal du groupe des terres rares. Pour la chercheuse, il est particulièrement intéressant, car il existe quatre nucléides radioactifs de terbium qui émettent différents types de rayonnement. Ils peuvent ainsi couvrir tout le spectre du diagnostic et du traitement en médecine nucléaire. Leur développement pour l’application clinique, toutefois, n’en est qu’au début, car certains de ces nucléides sont très difficiles à produire. L’isotope terbium-161, avec lequel Cristina Müller travaille actuellement, peut être produit au PSI. Il est fabriqué à partir d’un élément chimique, le gadolinium, à la source de neutrons SINQ, dans le cadre d’une collaboration entre le ZRW et le Laboratoire de radiochimie.
Attaque directe dans le noyau cellulaire
Le terbium-161 est un nucléide unique en son genre, explique Cristina Müller avec enthousiasme. Il émet deux types de rayonnement qui présentent une portée différente et se complètent. Ils peuvent donc être utilisées conjointement dans le traitement du cancer.
L’un de ces rayonnement est le rayonnement bêta moins, dont la portée est de quelques millimètres seulement. Il pénètre toute la cellule et des centaines de cellules voisines.
Le terbium-161 émet par ailleurs ce qu’on appelle des électrons Auger. Leur portée est de moins d’un micromètre et donc largement inférieure au diamètre d’une cellule. A l’extérieur de la cellule tumorale, ils ne seraient donc pratiquement d’aucune utilité. A l’intérieur du noyau cellulaire, en revanche, ils peuvent endommager les brins d’ADN de manière à ce que la cellule ne puisse plus se diviser. Dans nos expériences sur des cultures cellulaires, nous avons montré maintenant que ce principe fonctionnait vraiment et que les cellules présentaient davantage de cassures au niveau des double-brins de l’ADN, explique la pharmacienne. Mais cela ne se produit que si nous couplons d’abord la substance radioactive avec un SLN.
Pour comparer, la chercheuse et son groupe ont étudié des complexes moléculaires radioactifs contenant du terbium, mais pas de SLN. Ces complexes ont aussi entraîné la mort des cellules tumorales, mais avec un SLN, l’intensité de l’effet était démultipliée. Ce point sera ultérieurement important pour l’utilisation chez des patients, souligne Cristina Müller. S’il est possible d’administrer moins de nucléide radioactif, l’exposition aux radiations diminue. Mais nous devons encore étudier précisément d’autres effets secondaires possibles.
Un principe d’action universel qui promet une grande variété d’applications dans le traitement du cancer
Cristina Müller est convaincue qu’à l’avenir, la radiothérapie métabolique permettra de traiter plus efficacement certains types de cancer, avec moins d’effets secondaires que la chimiothérapie. En raison de la très faible portée de ses électrons Auger, le terbium-161 serait particulièrement approprié pour éliminer des cellules cancéreuses ou des amas cellulaires disséminés dans l’organisme. A cela s’ajoute que le rayonnement bêta moins de ce nucléide et sa demi-vie sont comparables à ceux du lutécium-177. Or le lutécium-177 est déjà utilisé aujourd’hui sur des patients pour le traitement du cancer. Mais par rapport au lutécium, le terbium présente un avantage: un effet double grâce à ses deux types de rayonnement. Et ce sans provoquer d’effets secondaires supplémentaires au niveau des reins. C’est ce qu’a montré la chercheuse dans une étude récemment publiée, menée sur des tissus rénaux de souris.
En dépit de leur potentiel important, les médicaments radiopharmaceutiques ont encore bien des années de travaux de développement devant eux. D’un côté, il faut découvrir quels sont les récepteurs de telles et telles cellules cancéreuses les plus susceptibles d’être occupés par un peptide marqué radioactivement. Ce peptide devrait adhérer de manière suffisamment ciblée pour ne pas endommager d’autres cellules. De l’autre, il faut que la combinaison entre le nucléide radioactif et le peptide soit la bonne, et il faut également lui adjoindre le SLN. Cristina Müller étudie donc méticuleusement chacun de ces paramètres. Avec notre recherche, nous cherchons à optimiser la radiothérapie métabolique à deux niveaux, d’un côté en utilisant un nucléide plus efficace, de l’autre en acheminant ce nucléide là où il agit le mieux, souligne la scientifique. Notre objectif est d’exploiter tout le potentiel d’un nucléide comme le terbium-161.
Texte: Sabine Goldhahn
Encadré explicatif: Rayonnement bêta moins et électrons Auger
Le terbium-161 est un radionucléide qu’étudient des chercheurs au PSI spécialisés dans les médicaments anticancéreux. Il produit deux types de rayonnement: le rayonnement bêta moins et des électrons Auger. En termes physiques, ces deux types de rayonnement sont composés d’électrons, mais ils diffèrent au niveau de leur origine dans l’atome et de leur énergie cinétique. Les électrons du rayonnement bêta moins apparaissent lorsqu’un neutron se désintègre dans le noyau atomique pour se transformer en un proton et un électron. Ces électrons ont une énergie cinétique élevée et de ce fait une portée relativement importante dans les tissus.
Les électrons Auger, en revanche, sont issus de la couche électronique qui entoure le noyau atomique. Ils sont éjectés de cette couche lors d’un processus complexe. Leur énergie et donc leur portée dans les tissus sont nettement plus faibles que celle des électrons qui apparaissent lors du processus bêta moins. Alors que le rayonnement bêta moins est déjà utilisé à des fins médicales sur des patients, les électrons Auger ne sont utilisés pour l’instant qu’en conditions de laboratoire. Pour en savoir plus sur les électrons Auger, vous pouvez vous reporter à Wikipédia.
Informations supplémentaires
- Un aperçu du travail du Centre des sciences radiopharmaceutiques propose l'article:
Attaquer le cancer de manière ciblée
. - Un aperçu sur le développement et la production d’un médicament particulier au Centre des sciences radiopharmaceutiques proposent les articles:
Développement d'un nouveau médicament contre le cancer de la thyroïde
etDes médicaments fabriqués avec la plus haute précision
. - L’article décrit comment les chercheurs du PSI développent des procédés efficaces pour produire des radionucléides destinés au diagnostic médical:
Nucléide spécialement conçu pour des applications médicales
. - Comment les chercheurs du PSI produisent des radionucléides:
Dans la ligne de mire des protons
.
Contact
PD Dr Cristina Müller, cheffe du groupe Chimie du nucléide du Centre des sciences radiopharmaceutiques de l’Institut Paul Scherrer PSI, de l’ETH Zurich et de l’Hôpital universitaire de ZurichInstitut Paul Scherrer, 5232 Villigen PSI, Suisse
Téléphone: +41 56 310 44 54, e-mail: cristina.mueller@psi.ch