Forschende am Paul Scherrer Institut PSI haben einen Wirkstoff entwickelt, mit dem sich eine besonders bösartige Form von Schilddrüsenkrebs besser finden und behandeln lässt. Sie verwenden ein Eiweiss, das dem körpereigenen Hormon Gastrin ähnelt und statten es zusätzlich mit einer radioaktiven Substanz aus. Das auf diese Weise radioaktiv markierte Eiweissmolekül kann aufgrund seiner Form entsprechend dem Schlüssel-Schloss-Prinzip an passende Rezeptoren an der Oberfläche von Tumorzellen andocken. Die Strahlung der radioaktiven Substanz kann dann den Tumor zerstören und verschont dabei aufgrund ihrer kurzen Reichweite umliegendes Gewebe weitgehend. Ein Vorteil des neuen Wirkstoffs ist, dass sich mit ihm eine Form von Schilddrüsenkrebs behandeln lässt, bei der die sonst etablierte Therapie mit Radio-Jod nicht wirkt. Die Forschenden am PSI haben das neue Mittel so weit entwickelt, dass eine erste Studie an Krebspatienten am Universitätsspital Basel starten kann.
Das medulläre Schilddrüsenkarzinom ist die dritthäufigste Krebsart an der Schilddrüse. Obwohl es mit weniger als zehn Prozent aller Schilddrüsenkarzinome eher selten ist, gehört es zu den besonders aggressiven Formen, denn es bildet leicht Tochtergeschwülste. Etwa ein Viertel dieser Tumore wird vererbt, sodass manchmal schon Kinder oder junge Erwachsene betroffen sind. Die ersten Krankheitszeichen sind ein Knoten am Hals und Schluckstörungen, später kommen Heiserkeit und Atemprobleme hinzu. Am Anfang können eine vollständige operative Entfernung der Schilddrüse und anschliessende Chemotherapie den Patienten heilen. Wenn der Tumor aber Tochtergeschwülste gebildet hat, ist eine Heilung fast ausgeschlossen
, sagt Martin Béhé vom Zentrum für radiopharmazeutische Wissenschaften am Paul Scherrer Institut PSI. Zwar kann ein Patient acht bis fünfzehn Jahre überleben, doch produzieren der Tumor oder seine Tochtergeschwülste Hormone, die zu Nebenwirkungen wie Bluthochdruck und starkem Durchfall führen. Das schränkt die Lebensqualität der Patienten erheblich ein.
Der Grund für die Hormonproduktion liegt in der Art der Tumorzellen. Anders als bei den häufigeren Formen von Schilddrüsenkrebs geht das medulläre Schilddrüsenkarzinom nicht von dem typischen jodspeichernden Gewebe in der Schilddrüse aus und kann deshalb nicht mit der wirksamen Radio-Jod-Therapie bekämpft werden. Es entstammt den sogenannten C-Zellen. Diese befinden sich im Bindegewebe der Schilddrüse und produzieren das Hormon Calcitonin, welches im Kalzium-Phosphat-Stoffwechsel eine Rolle spielt. An ihrer Oberfläche tragen die C-Zellen ein Molekül, das normale Schilddrüsenzellen nicht haben: den Rezeptor Cholecystokinin-2 (CCK2). Dort binden unter anderem die körpereigenen Hormone Cholecystokinin und Gastrin. Da bei etwa 92 Prozent aller medullären Schilddrüsenkarzinome besonders viele solche CCK2-Rezeptoren auftreten, ist dieses Molekül der ideale Angriffspunkt für eine gezielte Behandlung – vorausgesetzt, man findet einen Stoff, der eine ähnliche chemische Struktur hat wie Gastrin und somit ebenfalls am CCK2-Rezeptor bindet. So ein spezifisches Molekül kann man mit einer geeigneten radioaktiven Substanz koppeln und auf diese Weise die Radioaktivität direkt zu einzelnen Krebszellen transportieren
, sagt der Chemiker Béhé und erklärt: Dort kann der Wirkstoff andocken und den Krebs mit seiner Strahlung zerstören.
EU-Förderung unterstützte die Arbeit
Um einen geeigneten Wirkstoff zu finden, haben Béhé sowie andere europäische Wissenschaftler gemeinsam im Rahmen der von der Europäischen Union geförderten Initiative COST (European Cooperation in Science and Technology) zwölf mögliche radioaktiv markierte Arzneimittel getestet. Das Ziel war, jenes Mittel zu entdecken, das spezifisch an den CCK2-Rezeptor bindet, besonders viele Tumorzellen vernichtet und die geringsten Nebenwirkungen verursacht. Nach mehrjähriger Suche hatten schlussendlich Béhé und seine Gruppe am PSI Erfolg: Sie kombinierten ein Minigastrin (PSIG-2), das kleiner ist als ein normales Gastrinmolekül, mit dem radioaktiven Nuklid Lutetium-177 und nannten den neuen Wirkstoff 177LU-PSIG-2.
Kleine Änderung mit grosser Wirkung
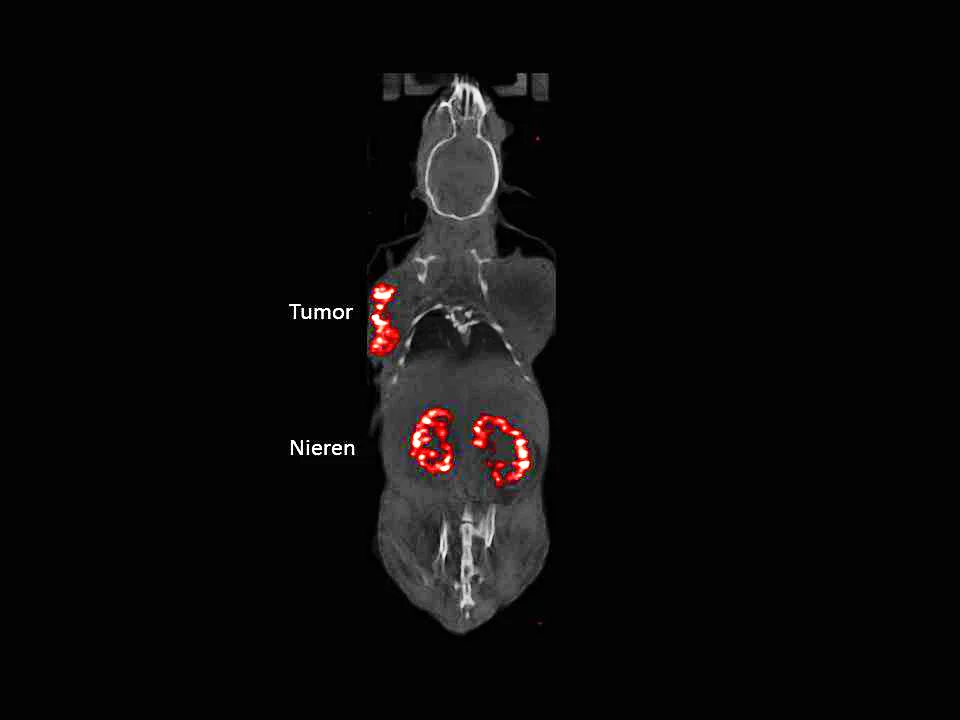
Der Weg bis zu diesem Radiopharmakon 177LU-PSIG-2 war alles andere als geradlinig. Zunächst experimentierten die Forschenden mit einem Abkömmling des Hormons Gastrin, welcher schon gut an den CCK2-Rezeptor andockte. Die ersten Ergebnisse waren vielversprechend: Sowohl im Tierversuch als auch beim ersten Einsatz am Menschen ging das medulläre Schilddrüsenkarzinom sehr stark zurück. Doch das neue Präparat reicherte sich nicht nur an den Krebszellen an, sondern auch in den Nieren. Dort verblieb die Substanz länger als gewünscht und hätte somit das Gewebe schädigen können. Damit war der neue Stoff wieder vom Tisch. Erst mussten die Wissenschaftler den Grund für die starke Anreicherung in den Nieren finden.
Bei ihrer Suche entdeckten sie, dass die Ursache für die Anreicherung in bestimmten Aminosäuren – den Glutaminsäuren – liegt, aus denen viele Hormone und andere Eiweissmoleküle bestehen. Sechs Glutaminsäuren in der chemischen Struktur des Präparats sorgen dafür, dass das Mittel leicht in die Niere aufgenommen wird. Daher galt es, die Anzahl dieser Bausteine zu verringern, um die Aufnahme zu blockieren. Doch das Ergebnis war nicht wie erhofft. Je weniger Glutaminsäuren das Molekül hatte, desto anfälliger wurde es für den Angriff von körpereigenen Enzymen, die es funktionsuntüchtig machten. Daher mussten die sechs Glutaminsäuren im Molekül verbleiben. Um die damit verbundene starke Anreicherung des radioaktiven Arzneimittels in den Nieren zu verhindern, griffen die Forschenden zu einem anderen Trick. Sie ersetzten die natürlichen Glutaminsäuren durch ihre künstlichen Pendants. Diese werden von den körpereigenen Enzymen nicht erkannt und können damit nicht zerstört werden, und ihre Aufnahme in die Nieren ist trotzdem nur gering.
Wissenschaftler nutzen Beta- und Gammastrahlung aus
Schliesslich musste Béhé mit seinem Team noch ein weiteres Problem lösen: Das Minigastrin PSIG-2 enthielt noch die Aminosäure Methionin. Diese kann sich chemisch so stark verändern, dass der Gastrinabkömmling nicht mehr gut an den CCK2-Rezeptor bindet. Also ersetzten die Forschenden das Methionin durch die stabile Aminosäure Norleucin. Damit war PSIG-2 nach über zehn Jahren Entwicklungsarbeit endlich fertig. Was dann folgte, war für die Experten am PSI Routine und dauerte nur noch drei Jahre: Sie mussten ein geeignetes radioaktives Nuklid an das Minigastrin anhängen und entschieden sich für Lutetium-177, weil es sowohl Betastrahlung als auch Gammastrahlung aussendet. Die Betastrahlung kommt im Körper nur wenige Millimeter weit und kann, sobald das Radiopharmakon angedockt hat, den Tumor direkt zerstören, ohne umliegendes Gewebe zu schädigen. Die Gammastrahlung hingegen dringt aus dem Körper wieder heraus und kann von einer Gammakamera erfasst und gemessen werden. Anhand der Messwerte erstellt diese ein Bild, auf dem man die Anreicherung der radioaktiven Substanz im Körper sehen und die Ausbreitung des medullären Schilddrüsenkarzinoms erkennen kann. Wir haben den neuen Wirkstoff hier am PSI jetzt so weit entwickelt, dass wir ihn standardisiert nach pharmazeutischen Vorschriften herstellen können. Deshalb haben wir bei der Schweizerischen Zulassungs- und Aufsichtsbehörde für Heilmittel Swissmedic ein Gesuch für seine Zulassung im Rahmen einer klinischen Studie eingereicht
, freut sich Béhé.
Sobald das Radiopharmakon 177LU-PSIG-2 für die Anwendung am Menschen im Rahmen einer klinischen Studie zugelassen ist, werden es die Ärzte der Nuklearmedizinischen Klinik an der Universität Basel an Studienpatienten einsetzen. Diese Studie zum medullären Schilddrüsenkrebs im fortgeschrittenen Stadium ist bereits von der Ethikkommission genehmigt und wird von der Krebsliga Schweiz unterstützt.
Text: Sabine Goldhahn
Weiterführende Informationen
- Wie das in diesem Artikel genannte Medikament für die Anwendung beim Patienten hergestellt wird, beschreibt der Text:
Medikamente punktgenau hergestellt
. - Einen Überblick über die Arbeit des Zentrums für radiopharmazeutische Wissenschaften (ZRW) bietet der Artikel
Gezielt gegen Krebs
. Das ZRW arbeitet auch an einer Methode, mit der radioaktive Substanzen in den Zellkern einer Krebszelle eingeschleust werden können:Den Krebs im Inneren treffen
. - Wie PSI-Forschende effiziente Verfahren zur Erzeugung von Radionukliden für die medizinische Diagnostik entwickeln, berichtet der Artikel:
Designernuklid für medizinische Anwendungen
. - Wie Forschende am PSI Radionuklide erzeugen:
Im Fokus der Protonen
.
Kontakt/Ansprechpartner
Dr. Martin Béhé, Leiter der Gruppe Pharmakologie des Zentrums fürradiopharmazeutische Wissenschaften des Paul Scherrer Instituts PSI,
der ETH Zürich und des Universitätsspitals Zürich
Telefon: +41 56 310 28 17, E-Mail: martin.behe@psi.ch