Tumeurs oculaires
Fin 2024, nous avions irradié avec succès au PSI plus de 8200 patientes et patients atteints de tumeurs oculaires. Les résultats suivant l’irradiation de ces tumeurs avec des protons sont très bons. Dans plus de 98% des cas, la croissance tumorale a pu être stoppée définitivement ou la tumeur a disparu. Dans plus de 90% des cas, l’œil atteint par la tumeur a pu être sauvé (Pica et al. 2023, Mouvet et al. 2019, Hennings et al. 2018, Via et al. 2018, Petrovic et al. 2014, Egger et al. 2003, Egger et al. 2001).
Nous irradions aussi les hémangiomes bénins avec 4 fois 5 Gy(RBE).
Méningiomes
Plus de 250 patientes et patients traités au PSI étaient atteints d’un méningiome. Ces tumeurs se développent à partir des enveloppes du cerveau (méninges) et se situent entre les os du crâne et la surface du cerveau. D’habitude, elles ne métastasent pas. Les tumeurs grossissent lentement et provoquent une pression due à l’effet de masse. Elles peuvent infiltrer les os du crâne environnants et la musculature alentour. Suivant leur localisation et leur taille, les méningiomes peuvent provoquer par exemple de violents maux de têtes, des crises d’épilepsie, des dysfonctions cérébrales, des troubles de la conscience, des paralysies et d’autres déficits neurologiques. Quand l’ablation chirurgicale complète des tumeurs n’est pas possible, une radiothérapie peut être indiquée. Les méningiomes atypiques (OMS grade II) et les méningiomes malins (OMS grade III) sont des affections où souvent une irradiation avec des protons est spécialement indiquée, car ces tumeurs nécessitent des doses plus élevées comparées aux méningiomes de grade I (OMS). La protonthérapie permet une adaptation spatiale très précise de la dose de radiation à proximité de structures sensibles comme les nerfs optiques (Krcek et al. 2023, Murray et al. 2017, Weber et al. 2012, Weber et al. 2004).
Gliomes de bas grade du cerveau et de la moelle épinière
Plus de 110 irradiations avec des protons ont été conduites sur des tumeurs cérébrales de bas grade, appelées gliomes de bas grade (GBG). Les gliomes se développent en grande partie à partir des cellules gliales, le tissu de soutien du cerveau. Plus leurs cellules sont encore similaires à leurs cellules d’origine, plus les succès du traitement sont importants. Dans ces cas-là, nous parlons de tumeurs de grade I et de grade II. D’après les connaissances scientifiques actuelles, quand les tumeurs se sont davantage éloignées de leurs cellules d’origine – nous disons qu’elles sont dédifférenciées – la protonthérapie n’offre pas de meilleur contrôle des tumeurs que l’irradiation moderne avec des photons produits par des accélérateurs linéaires. Pour cette raison, les tumeurs cérébrales de grade III et de grade IV, ainsi que les glioblastomes multiformes ne font pas partie du programme médical au PSI. Le plus souvent, ces patients sont présentés au tumorboard de neuro-oncologie, avant que leur cas ne soit discuté au sein du tumorboard du Centre de protonthérapie (CPT) du PSI. Cela permet de garantir que la patiente ou le patient se verra administrer le meilleur traitement possible (Willmann et al. 2023, Badiyan et al. 2017).
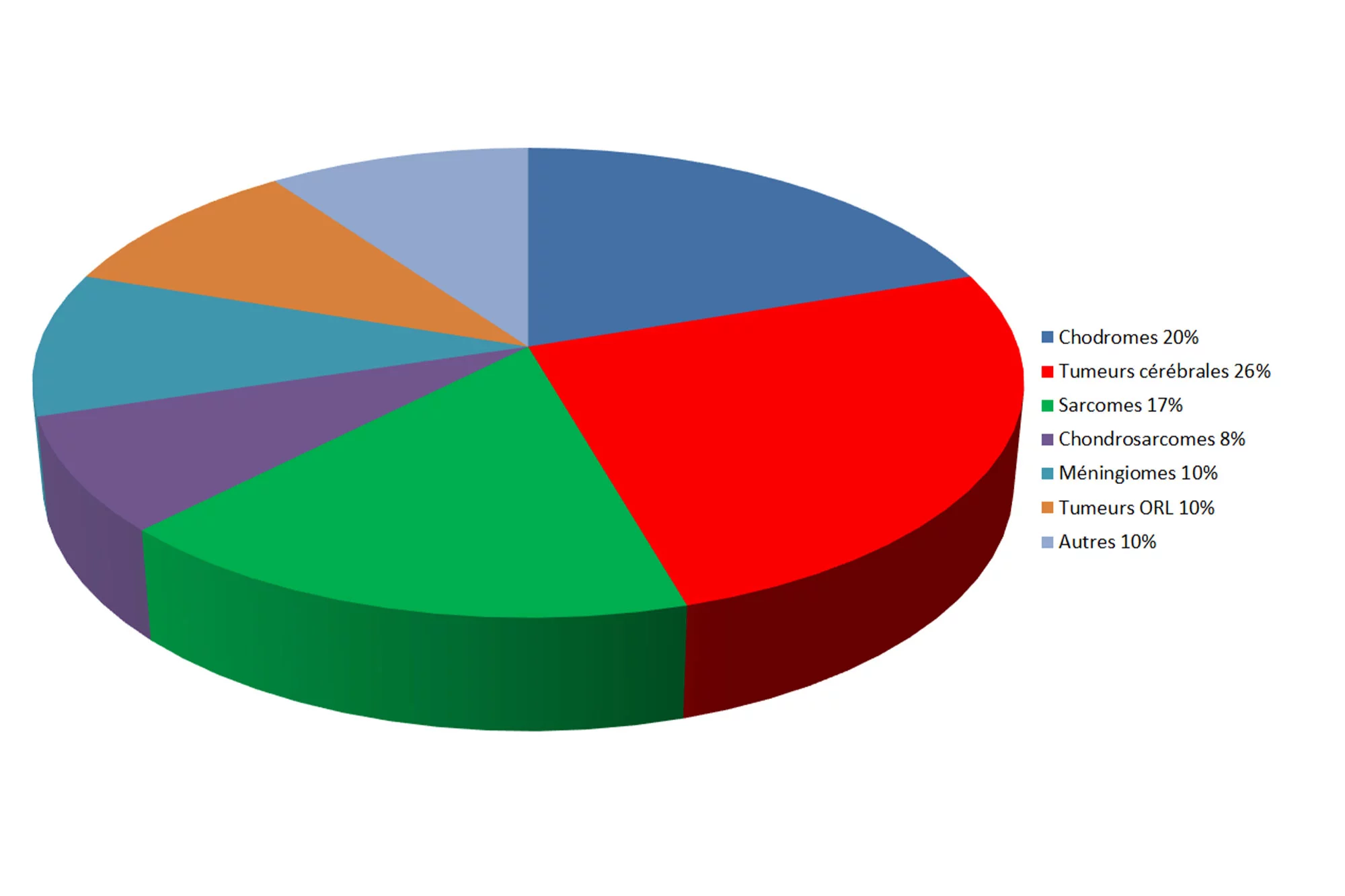
Chondrosarcomes et chordomes de la base du crâne et de la colonne vertébrale
Plus de 670 patientes et patients ont été irradiés avec des protons depuis 1996 au PSI pour un chondrosarcome ou un chordome situé au niveau de la base du crâne ou de la colonne vertébrale. De nombreux articles spécialisés ont été publiés sur ces 25 années d’expérience dans le domaine de l’irradiation de ces tumeurs rares (Walser et al. 2021, Beer et al. 2020, Tran et al. 2019, Weber et al. 2018, Snider et al. 2018, Stieb et al. 2017, Weber et al. 2016, Schneider et al. 2013, Pehlivan et al. 2012, Staab et al. 2011, Ares et al. 2009, Weber et al. 2005).
Ces tumeurs se développent dans l’os et/ou dans le tissu conjonctif, leur croissance est lente et elles métastasent rarement. Mais elles détruisent les structures voisines saines, qui sont sensibles et souvent vitales. Comme les faisceaux de protons s’arrêtent à une profondeur calculable et libèrent la plus importante quantité de radiation de manière contrôlable dans cette zone d’arrêt (le pic de Bragg), on irradie depuis de nombreuses années les chordomes et les chondrosarcomes de la base du crâne dans le cadre d’un programme cohérent et sérieux, surtout au Harvard Cyclotron / Massachusetts General Hospital à Boston. Comparé à l’irradiation avec des photons produits par des accélérateurs linéaires, le taux de contrôle local de la tumeur a pu être amélioré: il est passé d’environ 40% à 80% pour les chondrosarcomes, et de 5% à plus de 50% pour les chordomes.
En 1999 déjà, nous avons été les premiers à mener une protonthérapie chez un jeune homme pour traiter un chondrosarcome au niveau du rachis dorsal avec un procédé IMPT (protonthérapie par modulation d’intensité) développé au PSI. Cela a permis de protéger optimalement la moelle épinière, si bien qu’aujourd’hui, 20 ans après la fin de cette radiothérapie, le patient peut mener une vie tout à fait normale. Avec les mélanomes oculaires, ces tumeurs sont devenues une indication incontestée pour la protonthérapie.
Sarcomes
Les sarcomes sont des tumeurs cancéreuses malignes du tissu conjonctif et du tissu de soutien. Ils apparaissent dans toutes les régions du corps humain, par exemple au niveau du bassin et de la colonne vertébrale ou dans d’autres os et articulations, ainsi que dans les tissus musculaires. Ils nécessitent un traitement avec de très hautes doses. Fin 2024, plus de 410 patientes et patients atteints d’un sarcome avaient été irradiés, le plus souvent après avoir subi une intervention chirurgicale ou en association avec une chimiothérapie (Vazquez et al. 2023, Weber et al. 2017, Weber et al. 2015, Weber et al. 2007).
Si le diagnostic est celui de tumeurs du groupe des sarcomes des parties molles, non opérables ou dont l’ablation nécessite des interventions chirurgicales radicales et implique une importante perte de fonction, le PSI propose une irradiation préopératoire ou définitive avec des protons, associée à une hyperthermie. Il s’agit d’une étude prospective (titre abrégé: HYPROSAR, descriptif de l’étude dans le registre Clinicaltrials), placée sous la direction de la Clinique de radio-oncologie de l’Hôpital cantonal d’Aarau, validée par la Commission d’éthique et menée en étroite coopération avec l’Hôpital universitaire de Zurich. Toutes les demandes émanant de patients atteints d’un sarcome ou de leur médecin traitant doivent être présentées avec la documentation correspondante au sarcoma board de l’Hôpital universitaire Balgrist à Zurich. Un comité d’experts décide alors si le patient est éligible pour l’étude. Pour de plus amples informations, veuillez prendre contact avec le Dr Dominic Leiser (dominic.leiser@psi.ch) (Datta et al. 2016).
Tumeurs du nez, de la gorge, de la bouche et des oreilles
Les tumeurs du nez, de la gorge, de la bouche et des oreilles (tumeurs ORL) se développent souvent à proximité immédiate des structures sensibles du cerveau, de la base du crâne et de la colonne vertébrale. Par ailleurs, les volumes qui doivent être irradiés sont souvent importants. Toutes ces raisons font que, fréquemment, ces tumeurs se prêtent à une protonthérapie. Il s’agit le plus souvent de carcinomes adénoïdes kystiques (CAC), de tumeurs parotidiennes bégnines ou malignes, ainsi que de tumeurs nasopharyngées de différents types de tissu tumoral. Fin 2024, nous avions traité plus de 250 tumeurs ORL, dans certains cas en association avec une chirurgie, une chimiothérapie et dans quelques rares cas également en association avec une irradiation conventionnelle avec des photons.(Walser et al. 2023, Pelak et al. 2020)
Tumeurs pédiatriques
Fin 2024, nous avions traité près de 900 enfants et adolescents âgés entre 1 et 18 ans. Ce programme présente les plus longs suivis d’enfants ayant été irradiés uniquement avec la technologie Spot Scan. Depuis 2004, le PSI s’est spécialisé dans le traitement des enfants en bas âge. En coopération avec l’équipe d’anesthésistes de l’Hôpital des enfants de Zurich, plus de 480 enfants âgés entre 1 et 9 ans ont été traités depuis sous narcose et pour ce faire, 12000 anesthésies ont été nécessaires. Les tumeurs étaient localisées dans la tête ou le tronc. Entre 14,0 et 74,0 Gy(RBE) ont été appliqués (dans quelques rares cas en association avec une photothérapie conventionnelle). Les plus grands groupes traités sont les épendydomes, les rhabdomyosarcomes, les crâniopharyngiomes, les médulloblastomes et les sarcomes d’Ewing. Souvent, ces tumeurs et d’autres plus rares sont irradiées en association avec une chimiothérapie (Bojaxhiu et al. 2018, Weber et al. 2017, Leiser et al. 2016, Ares et al. 2016, Weber et al. 2015, Weber et al. 2015b, Thompson et al. 2013, Rombi et al. 2013).
Presque tous les enfants et adolescents sont traités au sein d’un protocole d’étude ou conformément à un tel protocole. Tous les enfants et adolescents traités au PSI sont sollicités pour participer à une étude observationnelle prospective:
- étude sur la qualité de vie après irradiation avec des protons (Pediatric Quality of life = questionnaire Pedqol); projet de coopération avec l’Université de Bonn, Allemagne;
Point fort: enfants, adolescents et personnes jeunes
La répartition par âge de nos patients mérite une attention particulière: Presque 60% d’entre eux ont aujourd’hui moins de 40 ans et environ 35% d’entre eux sont des enfants et des adolescents de moins de 18 ans. Ces patientes et patients peuvent spécialement profiter de la protonthérapie. En effet, comparée à une irradiation avec des photons, la libération précise de la dose de radiation dans la tumeur et la faiblesse de la dose cédée en-dehors du volume de la tumeur permettent de beaucoup mieux ménager l’organisme de l’enfant ou de l’adolescent, qui est encore en croissance et particulièrement sensible. Cela réduit la probabilité de tumeurs secondaires ultérieures.