Im menschlichen Körper tauschen Zehntausende von Milliarden von Zellen unentwegt Informationen aus. Die meisten Zellen haben festgelegte Aufgaben. Die einen speichern Fett, andere nehmen visuelle Eindrücke wahr, sie produzieren Hormone oder bilden Muskeln. Damit der Körper funktioniert, ist es entscheidend, dass sich die Zellen koordinieren. Sie müssen in der Lage sein, ihre Umwelt zu erkennen und wissen, was um sie herum vorgeht. Dazu benötigen sie Sensoren, mit denen sie Signale aus ihrer Umgebung wahrnehmen können. Damit ermöglichen sie etwa unseren Augen, Licht wahrzunehmen, unserer Nase zu riechen oder unserem Mund zu schmecken.
Sensoren auf der Oberfläche von Zellen heissen Rezeptoren. Der Nobelpreis für Chemie geht in diesem Jahr an Robert J. Lefkowitz und Brian K. Kobilka. Sie haben herausgefunden, wie eine Familie von Rezeptoren funktioniert, die man G-Protein-gekoppelte Rezeptoren (GPCR) nennt. Zu dieser Familie von Rezeptoren gehören solche, die Adrenalin, Dopamin, Serotonin und Histamin sowie Licht, Geschmacksstoffe und Gerüche erkennen. Die meisten Prozesse, die in unserem Körper ablaufen, benötigen diese Rezeptoren. Auch rund die Hälfte aller Medikamente – wie etwa Beta-Blocker, Anti-Histaminika und verschiedene Psychopharmaka – wirken, indem sie diese Rezeptoren blockieren.
Das Wissen um die GPCR ist deshalb von erheblichem Nutzen für unsere Gesellschaft. Für die Forscher war es lange Zeit mit beträchtlichen Anstrengungen verbunden, sich dieses Wissen anzueignen. Die Rezeptoren sind nämlich aufgrund ihrer vergleichsweise geringen Anzahl im Körper nur schwer zu finden und verbergen sich zudem in der Zellmembran. Lefkowitz und Kobilka sind seit über 25 Jahren an der Spitze der GPCR-Forschung tätig. Zunächst gelang ihnen die Identifizierung einiger der ersten GPCR. Später beschrieben sie die Strukturen dieser Rezeptoren und schliesslich erarbeiteten sie eine detaillierte Beschreibung ihrer Funktionsweise.
GPCR-Forschung am Paul Scherrer Institut
Auch am PSI forschen Wissenschaftler an Strukturen und Funktionen G-Protein-gekoppelter Rezeptoren. Im Jahr 2010 etablierte Gebhard Schertler mit seinem Team diesen Forschungsschwerpunkt am PSI. Seitdem haben die Studien seiner Arbeitsgruppe bereits zum besseren Verständnis von Erbkrankheiten beigetragen, die mit den GPCR zusammenhängen. So trugen seine Arbeiten zur Struktur des Rhodopsins – eines lichtempfindlichen Rezeptors im Auge – wesentlich zum Verständnis des Sehens auf molekularer Ebene bei, da sein Team das Rhodopsin in seinem angeregten Zustand entschlüsseln konnte. Veränderte Rhodopsin-Moleküle sind ein Schlüssel zur Erforschung der verbreiteten Augenkrankheit Retinitis Pigmentosa (siehe auch Medienmitteilung des PSI vom 9. März 2011).
Die Pharmafirmen Roche, Heptares und Actelion haben sich entschieden, mit dem PSI eine Kooperation einzugehen, um die Erfahrung von Schertlers Team zur Struktur der GPCR für ihre pharmazeutische Forschung zu nutzen.
Ausblick
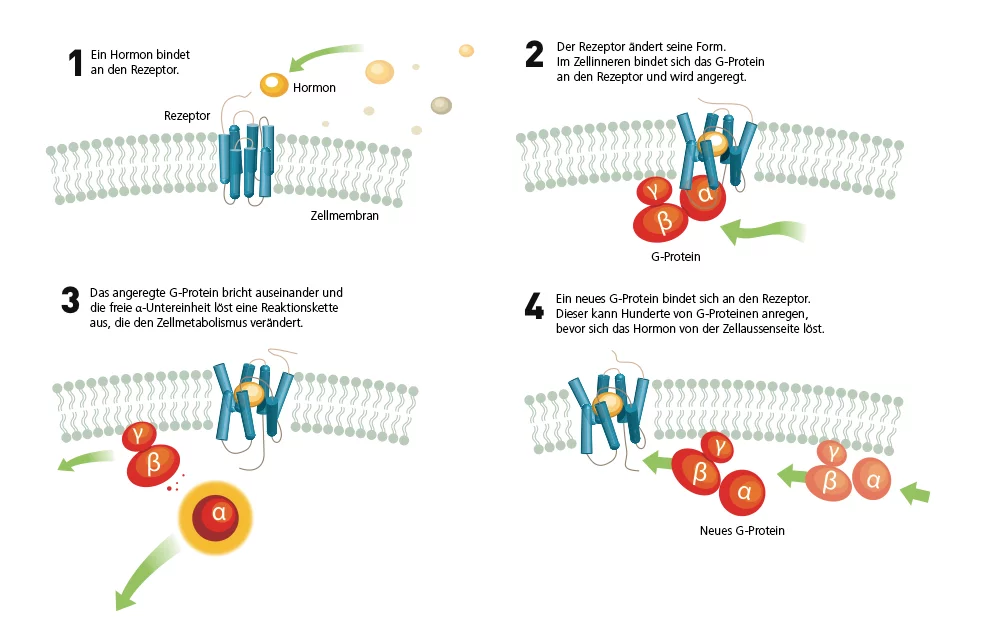
Trotz bahnbrechender Fortschritte auf dem Gebiet der GPCR-Forschung in den letzten 20 Jahren ist die Struktur der meisten dieser Rezeptoren noch nicht aufgeschlüsselt. Das liegt daran, dass sie sich mit den bisher zur Verfügung stehenden Methoden nicht dreidimensional oder gar in Bewegung sichtbar machen lassen. So gibt es bis heute nur einen einzigen GPC-Rezeptor, bei dem man im Detail den Augenblick beobachten konnte, in dem er sich an ein G-Protein bindet. Hier Fortschritte zu erzielen, ist die grosse Herausforderung der nächsten Jahre. Denn wenn man weiss, wie und wo genau sich Rezeptor und Protein im Zellinneren verbinden (Bild 2), kann man dieses Wissen für die Entwicklung neuer Medikamente nutzen. Ein zweiter interessanter Ansatzpunkt für Entwicklung und Weiterentwicklung von Medikamenten wäre die genaue Kenntnis darüber, wie ein Hormon sich von ausserhalb der Zelle an den GPC-Rezeptor in der Zellwand bindet (Bild 1). Solche Arzneimittel würden dann ganz gezielt an einer speziellen Stelle auf die Ablaufprozesse im Körper einwirken und nicht an unerwünschten Stellen.
Am PSI benutzen die Forscher ein ganzes Spektrum von Methoden, um die Rezeptoren zu beobachten, darunter Kristallografie, Elektronenmikroskopie, Magnetresonanz-Spektroskopie, Biophysik und Bioinformatik. Grosse Hoffnung setzen die Wissenschaftler auch auf die neue Grossforschungsanlage des PSI, den SwissFEL. Dieser soll ab 2016 ultraschnelle Vorgänge auf molekularer Ebene wie in einem Film sichtbar machen. Dazu könnte auch der Vorgang gehören, wie ein sich ausserhalb der Zellwand befindliches Hormon an G-Protein-gekoppelte Rezeptoren andockt, die sich innerhalb der Zellwand befinden – und wie diese Rezeptoren daraufhin die Informationen aus dem Hormon über ein G-Protein, das sich innerhalb der Zelle befindet, weitergeben.