Forschende am Paul Scherrer Institut untersuchen Proteine mehrerer Klassen, mit dem Ziel, deren Struktur und Funktion zu verstehen. Zu den Forschungsthemen gehört die Untersuchung von Proteinen, die als Bestandteile des Zellskeletts der Zelle ihre Gestalt verleihen und ihre Bewegungen ermöglichen oder von Membranproteinen, die bestimmen, welche Stoffe in eine Zelle hinein oder aus ihr heraustransportiert werden müssen oder wie Signale in die Zelle übertragen werden.
Neben der eigentlichen Erforschung von Proteinen engagieren sich die Forscher auch für die Entwicklung neuer Techniken zur Bestimmung von Proteinstrukturen – insbesondere mit Synchrotronlicht an der Synchrotron Lichtquelle Schweiz SLS – und für die robotisierte Herstellung grosser Mengen der benötigten Proteine.
Viele der gewonnenen Ergebnisse könnten dazu beitragen, dass langfristig neue Behandlungsmethoden gegen Krebs entwickelt werden. Denn die Forschung am PSI trägt dazu bei, dass lebenswichtige Prozesse in biologischen Zellen besser verstanden werden. Dieses Verständnis könnte dazu beitragen, solche Prozesse in Krebszellen gezielt zu blockieren und Krebszellen am weiteren Wachstum zu hindern oder zu zerstören.
Proteine – Grundbausteine des Lebens
Proteine bilden die Grundbausteine lebender Organismen. Diese kompliziert aufgebauten Moleküle übernehmen in der lebenden Zelle unzählige Aufgaben: sie geben den Zellen ihre Form, sie transportieren Substanzen durch die Zellen oder empfangen Signale, die von aussen die Zelle erreichen und leiten sie durch die Zellmembran ins Innere der Zelle weiter. Die genaue Funktion eines Proteins hängt dabei direkt mit seinem Aufbau zusammen – nicht nur mit der Folge seiner Grundbausteine (der Aminosäuren), sondern insbesondere mit seiner dreidimensionalen Form.Proteine im Zellskelett
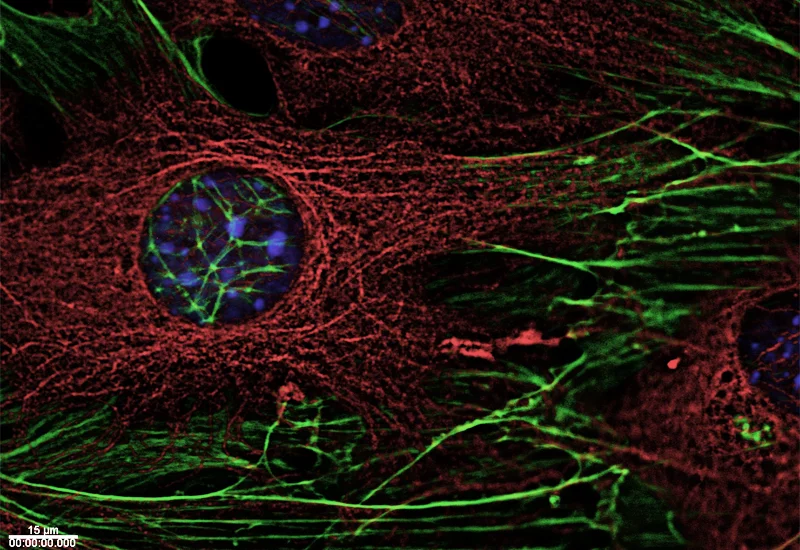
Das Zellskelett, ein Geflecht von Polymerfasern, durchzieht die gesamte lebende Zelle, es stabilisiert sie und hält sie in Form. Es bildet dabei kein steifes Gerüst, sondern reagiert flexibel auf äussere Einflüsse und die spezifischen Bedürfnisse der Zelle und ist aktiv an zahlreichen lebenswichtigen Vorgängen in der Zelle beteiligt:
Seine Fasern sorgen dafür, dass die Zelle bei Bedarf ihre Form gezielt verändert, sie trennen bei der Zellteilung die für die beiden sich neu bildenden Zellen bestimmten Chromosomen voneinander, oder beteiligen sich daran, zelluläres Material an seinen Bestimmungsort innerhalb der Zelle zu transportieren.
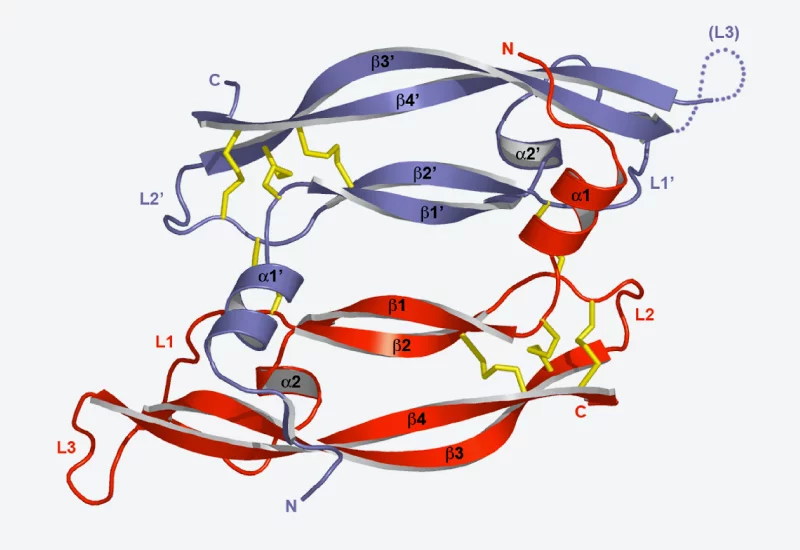
Die Forschenden am PSI untersuchen die Struktur der am Zellskelett beteiligten Proteine, um zu verstehen wie Struktur und Funktion zusammenhängen. So haben sich die Forscher am PSI mit Proteinen beschäftigt, die die Enden von Fasern des Zellskeletts mit den verschiedenen Zellbestandteilen wie Chromosomen oder der Zellmembran verbinden. Dabei konnten sie den Mechanismus aufklären, der ermöglicht, dass diese Proteine die Faserenden erkennen und sich an sie binden können.
Kommunikation durch die Zellmembran
Eine lebende Zelle steht als Teil eines lebenden Organismus stets im Austausch mit ihrer Umgebung. So erreichen die Zelle von aussen Signale, die Vorgänge innerhalb der Zelle auslösen. Gleichzeitig muss der Austausch von Stoffen zwischen dem Zellinneren und der Umgebung gesteuert werden. All diese Vorgänge werden von speziellen Proteinen gesteuert, die in Abhängigkeit von den Bedingungen ihre Form und damit ihr Verhalten ändern.
So gibt es eine Vielzahl von Proteinen, die sich in der Membran einer Zelle befinden und Signale von aussen nach innen weitergeben. Ein solches Signal kann zum Beispiel ein Neurotransmittermolekül sein, das ein Signal von einer Nervenzelle zur nächsten überträgt. Oder ein Molekül, das mit der Abkürzung VEGF bezeichnet wird, und bestimmte Zellen dazu anregt, sich zu Blutgefässen zu entwickeln. VEGF verbindet sich mit den Enden eines Proteins, eines sogenannten Rezeptors, das auf der Aussenseite der Zelle erreichbar ist. Die Bindung von VEGF an den Rezeptor bewirkt eine Veränderung der Rezeptorstruktur. Diese Strukturänderung wirkt sich innert Sekunden auch auf der Innenseite der Zellmembran aus und löst bestimmte chemische Reaktionen innerhalb der Zelle aus, die zu deren Veränderung führen.
Andere Proteine steuern den Austausch von Stoffen mit der Umgebung der Zelle. So beruht die Signalleitung in einer Nervenzelle darauf, dass im richtigen Augenblick bestimmte Ionen in die Zelle hinein- oder aus ihr herausgelangen. Dazu wirken bestimmte Membranproteine als Ionenkanäle, die die Ionen durch die Membran hindurchtransportieren.
Ziel der Forschenden am PSI ist es, für verschiedene Membranproteine die Struktur zu bestimmen und daraus ihre konkrete Funktion herzuleiten zu können. Dabei ergründen sie beispielsweise, wie sich die Strukturen der Proteine ändern, wenn sie mit einem Signalmolekül verbunden sind.
Neue Methoden der Strukturbiologie
Für ihre Arbeit nutzen die Forschenden die ganze Vielfalt von Verfahren der Strukturbiologie, entwickeln aber auch neue Methoden mit. Das reicht von automatisierten Verfahren zur Herstellung grosser Mengen der benötigten Proteine bis zu exakten Untersuchungsverfahren mit Synchrotronlicht an der SLS. Für die Strukturuntersuchungen werden Proteine in Mengen benötigt, die bei Weitem die Mengen übersteigen, in denen diese in lebenden Organismen vorkommen. Hier arbeiten Forschende des PSI an der Entwicklung von Verfahren mit, in denen komplexe Herstellungsprozesse mit Hilfe von Robotern
automatisiert werden.
Mit der Synchrotron Lichtquelle Schweiz verfügt das PSI über eine Anlage, die für die Strukturbiologie einzigartige Möglichkeiten eröffnet. So arbeiten die Forschenden daran, die Methode der Kleinwinkelstreuung mit Synchrotronlicht an die Bedürfnisse der Strukturbiologie anzupassen. Das Verfahren erlaubt es, die dreidimensionale äussere Form von Proteinen zu bestimmen, die sich in einer Flüssigkeit gelöst befinden. Diese Methode ergänzt die gut etablierte Proteinkristallographie mit Synchrotronlicht, die zurzeit die besten Proteinstrukturen liefert, aber voraussetzt, dass die Proteine als Kristalle vorliegen. Vielfach lassen sich aber Proteine nicht kristallisieren, in anderen Fällen beeinflusst die Tatsache, dass die Proteine zu Kristallen zusammengebaut sind, deren Form. Die Methode der Kleinwinkelstreuung ergänzt die heute üblichen Verfahren zur Proteinstrukturbestimmung in idealer Weise.
Weiterführende Informationen
- Forschen mit Synchrotronlicht
Ein wichtiges Werkzeug der Strukturbiologie - Synchrotron Lichtquelle Schweiz SLS
Die Synchrotronlichtquelle des PSI - Labor für Biomolekulare Forschung
Webseite des Labors (in Englisch)