Experimente am SwissFEL werden helfen, wesentliche Lebensprozesse zu verstehen. Sie werden zeigen, wie lebenswichtige Biomoleküle aufgebaut sind, deren Struktur mit heutigen Methoden nicht bestimmt werden kann. Und sie werden zeigen, wie sich die Form der Moleküle verändert. Die Erkenntnisse werden helfen, Krankheiten zu verstehen und Medikamente zu entwickeln.
Biologische Moleküle übernehmen in lebenden Organismen unzählige Aufgaben. Sie geben beispielsweise Informationen, die von aussen zu einer lebenden Zelle gelangen, ins Zellinnere weiter oder bauen nach dem im Erbgut niedergelegten Bauplan lebensnotwendige Substanzen auf. Jedes dieser Moleküle funktioniert wie eine winzige hoch exakte Maschine, deren Bauteile eine genau vorherbestimmte Form haben müssen, damit sie ihre Aufgabe erfüllen kann.
Herauszubekommen, wie die Moleküle aufgebaut sind und wie sie „funktionieren“, ist heute Ziel zahlreicher Wissenschaftler und Wissenschaftlerinnen. Forschung am SwissFEL wird unser Wissen um die Biomoleküle stark erweitern – sie wird den Aufbau von Molekülen zeigen, die heutigen Verfahren nicht zugänglich sind, und die Moleküle auch „in Aktion“ zeigen, statt nur in einem Ruhezustand. Mit diesem Wissen kann man fundamentale Vorgänge in verschiedenen Organismen besser verstehen und Grundlagen für die Behandlung von Krankheiten schaffen. Man kann erkennen, wie fehlerhaft aufgebaute Moleküle Krankheiten verursachen und wie neuartige Medikamente wirken müssten, um gezielt in die Lebensprozesse von Krankheitserregern einzugreifen.
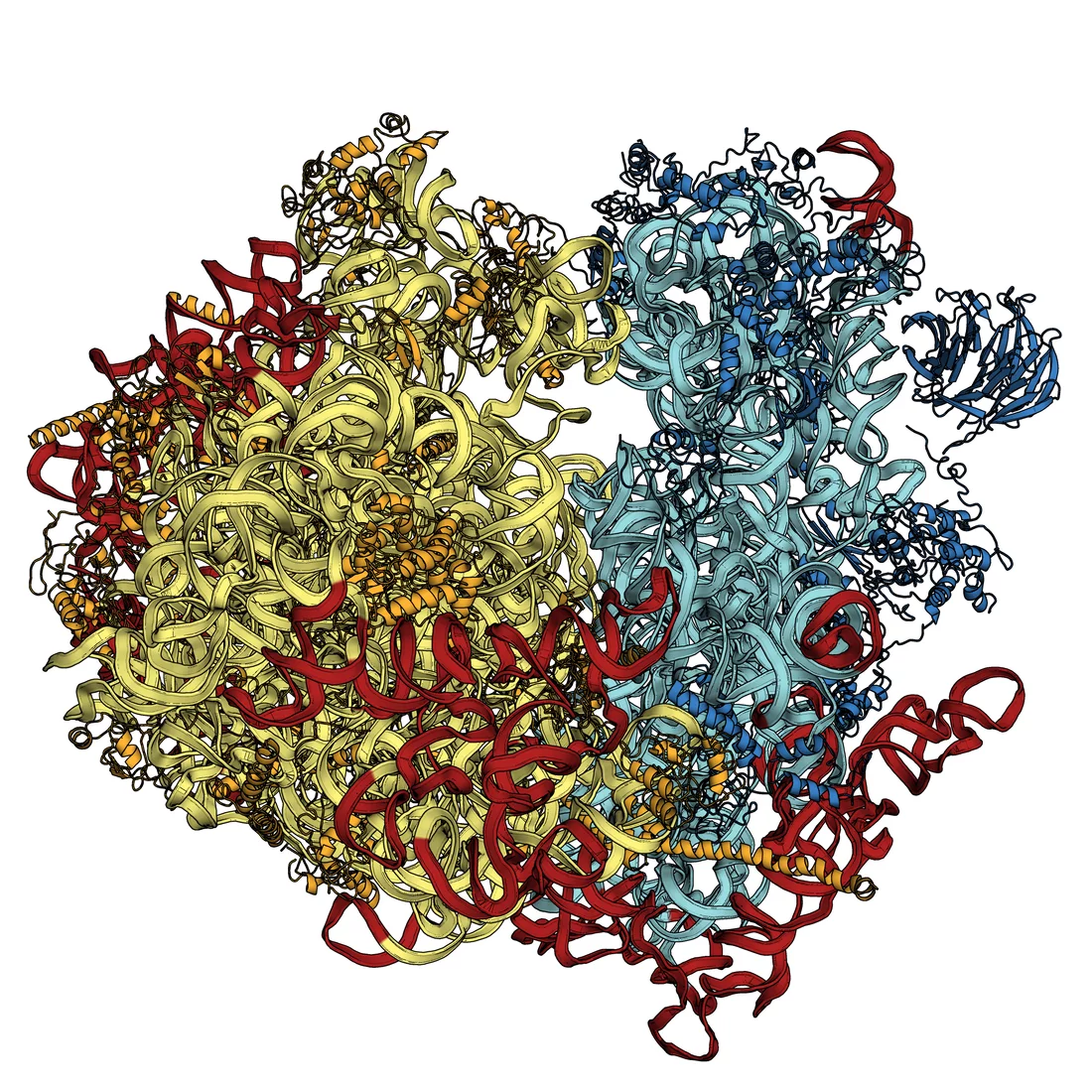
Schon heute ist es möglich, mit Experimenten an der Synchrotron Lichtquelle Schweiz SLS des PSI oder ähnlichen Anlagen statische Strukturen von Biomolekülen zu bestimmen. Damit wurde zum Beispiel die Funktionsweise von Ribosomen aufgeklärt, die in der Zelle Proteinmoleküle nach den im Erbgut niedergelegten Bauplänen aufbauen. Für diese Arbeiten wurde 2009 der Chemienobelpreis vergeben. Ein Nachteil des an der SLS genutzten Verfahrens ist, dass hier Proteinkristalle benötigt werden, in denen viele Tausend Exemplare des gleichen Moleküls in einer regelmässigen Struktur angeordnet sind. Es gibt aber zahlreiche Moleküle, für die es nicht möglich ist, die an der SLS benötigten Kristalle herzustellen. Dazu gehören viele Membranproteine, die den Austausch zwischen dem Zellinneren und der Umgebung regeln. Sie lassen sich entweder gar nicht kristallisieren oder man erhält nur Kristalle in der Grösse einiger hundert Nanometer, die zu klein sind. Am SwissFEL wird man auch die Strukturen dieser Moleküle bestimmen können.
Maschinen des Lebens in Bewegung
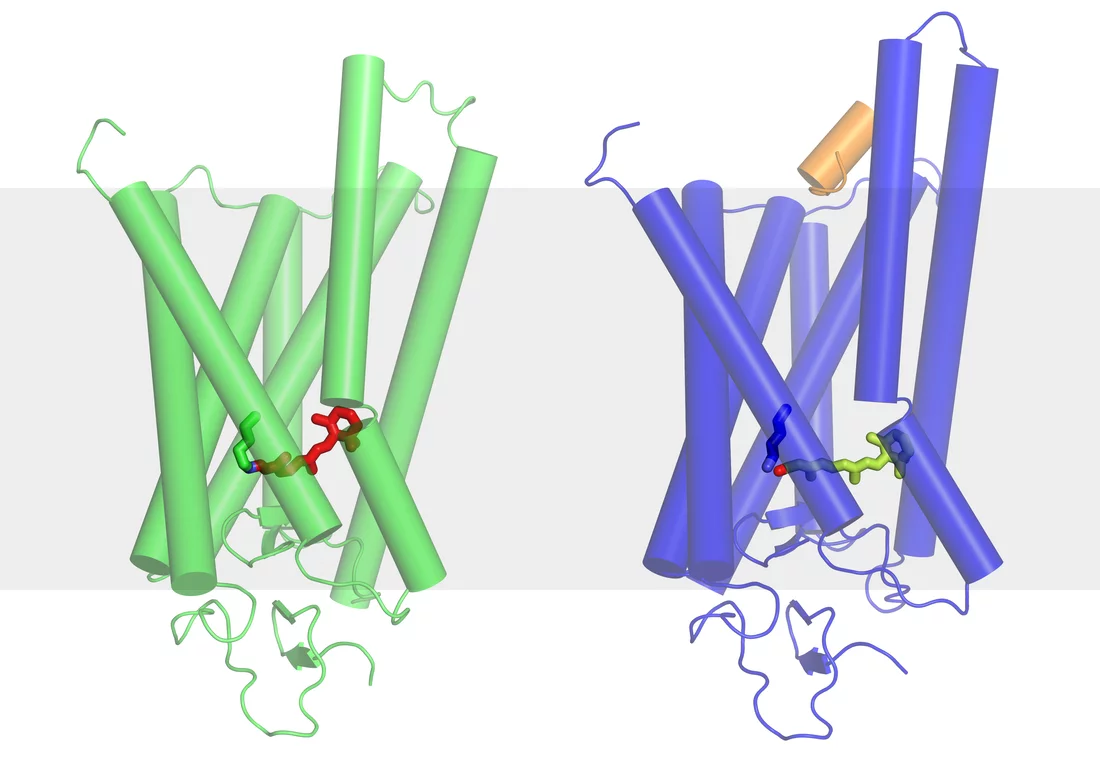
Experimente am SwissFEL werden erstmals ermöglichen, komplexe Biomoleküle in Bewegung zu beobachten. Es gehört zur Natur dieser Moleküle, dass sie immer wieder ihre Form verändern. So wird zum Beispiel das Protein Rhodopsin in unseren Augen durch einfallendes Licht dazu angeregt, seine Form zu verändern. Die Veränderung stösst weitere chemische Vorgänge an, die schliesslich einen Nervenimpuls in Richtung Gehirn erzeugen. Nach einer kurzen Zeit kehrt das Molekül in seine Ausgangsform zurück und ist wieder für Licht empfänglich. Ähnliche Veränderungen finden für die meisten Moleküle statt. Und auch wenn die Anfangs- und Endkonfiguration des Moleküls bekannt sind, gibt es bislang keinen Weg, das Molekül während der Veränderung zu beobachten. Erst die extrem kurzen Röntgenlichtpulse des SwissFEL werden es möglich machen, die Zwischenzustände des Moleküls zu sehen und so deren Funktionsweise genau aufzuklären.
Hintergrundinformationen zu den in den Abbildungen dargestellten Forschungsprojekten:
Die Nanomaschinen des Lebens verstehen – Medienmitteilung zur Ribosomenforschung (http://psi.ch/1bMR)Grundstrukturen des Sehens entschlüsselt (http://psi.ch/qumv)
Wenn die Datenleitung in die Zelle versagt – Medienmitteilungen zur Forschung am Lichtsensor Rhodopsin (http://psi.ch/vNAY)