In aus dem Weltraum aufgenommenen Nachtfotos sind die grossen Metropolen der Erde an der Flut ihrer öffentlichen Beleuchtung leicht zu erkennen. Wohl nur das geübte Auge kann da jedoch nebst New York oder Tokyo auch den Standort mancher Erdölförderbrunnen ausmachen. Das Licht stammt in diesem Fall primär aus der Verbrennung von Methan. Diese Verschwendung eines energiereichen Gases hat gravierende ökonomische und ökologische Folgen. PSI-Forschende sind auf der Suche nach einer Lösung: die Umwandlung von Methan zum flüssigen Energieträger Methanol
Methan kommt oft in Erdölreservoirs vor und entweicht bei der Erdölförderung aufgrund seiner geringen Dichte – genauso wie das Kohlendioxid aus einer geöffneten Getränkeflasche zischend aufsteigt. Weil die Verarbeitung, Speicherung und Tranport des Methans bei dessen heutigen Marktpreisen zu teuer wäre, wird das Gas beim Erdölabbau nicht selten entweder gleich verbrannt –was CO2 produziert- oder einfach in die Atmosphäre geblasen. Durch diese als Flaring bzw. Venting bekannten Praktiken wurden im Jahr 2011 gemäss Statistiken der Weltbank weltweit 140 Milliarden Kubikmeter Methan in die Lufthülle unseres Planeten geschleudert. Das entspricht 30 Prozent des jährlichen Methanverbrauchs Europas und 75 Prozent der Methanexporte Russlands. Ökonomisch gesehen ist das Ausmass des verschwenderischen Umgangs mit einer derart wertvollen Naturressource enorm. Die negativen Folgen sind aber auch ökologischer Natur und umfassen die massive Verschlechterung der lokalen Luftqualität sowie –wenn das Gas direkt in die Atmosphäre gelangt- einen erklecklichen Beitrag zum Klimawandel, denn Methan ist ein viel potenteres Treibhausgas als Kohlendioxid.
Flüssig gewinnt
Jeroen van Bokhoven, Leiter des Labors für Katalyse und Nachhaltige Chemie am Paul Scherrer Institut PSI schwebt eine Lösung dieser enormen Umwelt- und Wirtschaftssünde vor: die Herstellung von Methanol aus Methan, direkt an der Quelle, würde das flüchtige Gas in einen leichter zu handhabenden Energieträger verwandeln. Speicherung und Transport zu den Verbrauchern wären bei Methanol wirtschaftlich und technisch machbar. Methanol hat mehrere Vorteile gegenüber Methan. Zum einen liegt es bei Zimmertemperatur und Normdruck in flüssigem Zustand vor. Zum anderen ist Methanol auf Grund seiner Molekülstruktur reaktionsfreudiger als Methan und bildet so einen besseren Ausgangssstoff für die Herstellung von Treibstoffen und anderen nützlichen Chemikalien. Doch bisher haben sich Chemiker an einer effizienten Gewinnung von Methanol aus Methan die Zähne ausgebissen. Die herkömmlichen Herstellungsmethoden sind zu aufwendig und deshalb wirtschaftlich uninteressant.
Das konventionelle Verfahren zur Umwandlung von Methan beinhaltet als ersten Schritt die sogenannte Dampfreformierung des Methangases. Bei der Reformierung wird dem Methan heisser Wasserdampf beigemischt- bei Temperaturen von mindestens 700 Grad Celsius. Dieser Prozessschritt verbraucht viel Energie. Aus der Reformierung ensteht ein Gemisch aus Kohlenstoffmonoxid und Wasserstoff, das man als Syngas bezeichnet. Das Syngas kann dann durch weitere chemische Reaktionen unter hohem Druck zu Methanol umgewandelt werden.
Eine direktere und weniger energieintensive Konversion von Methan zu Methanol wäre wünschenswert, hat sich aber aus fundamentalen Gründen als Knacknuss erwiesen. Methan ist durch seine symmetrische Molekülstruktur und durch die Stärke der Bindungen zwischen dem eizigen Kohlenstoffatom und den ihm umgebenden Wasserstoffatomen sehr stabil, das heisst, es lässt sich nur schwer chemisch umwandeln. Diese Schwierigkeit läst sich zwar durch den Einsatz von Katalysatoren umgehen – Substanzen, die eine chemische Reaktion begünstigen und beschleunigen können, ohne dabei selbst verbraucht zu werden. Aber die Suche nach dem richtigen Katalysator für die Methanolproduktion blieb trotz Jahrzehnten heissen Bemühens fruchtlos.
Die Thermodynamik steht im Wege
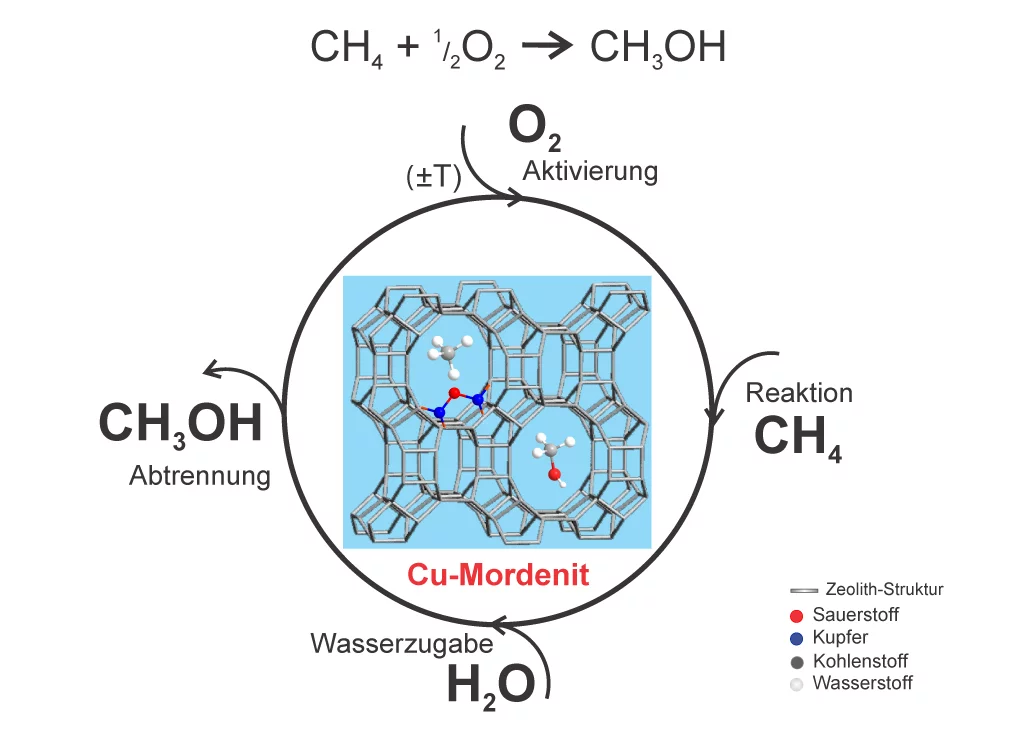
Es ist nämlich gegen den „Willen der Natur“, Methanol als Endprodukt der Umwandlung von Methan herzustellen. Oder in technischeren Worten: die Gesetze der Thermodynamik, welche die Umwandlung von Stoffen im Sinne der Energieminimierung regieren, begünstigen eher die sogenannte vollständige Oxidation von Methan. Diese hat aber als Ergebnis die Erzeugung von Kohlenstoffdioxid. Um Methanol zu erhalten, müsste man mithilfe eines Tricks den Oxidationsprozess zum richtigen Zeitpunkt anhalten. Dazu bedienen sich Chemiker eines sogenannten selektiven Katalyseurs, der Substanz also, die der Reaktion gerade über die energetische Hürde zur Herstellung von Methanol hinweghilft, das Fortfahren bis zum CO2 aber verhindert.
Erst vor wenigen Jahren ist Forschern die katalytische Umwandlung von Methan zu Methanol gelungen. Als Katalysator verwendeten sie einen mit Kupfer dotierten Zeolith, Kupfer-Mordenit genannt – ein natürlich vorkommendes, aber auch chemisch synthetisierbares Mineral aus Aluminium, Silizium und Sauerstoff. Werden Metallatome in die Poren der Kristallstruktur dieser Zeolithe eingebaut, fungieren diese als besonders effiziente selektive katalytische Zentren. Die Gewinnung von Methanol aus Methan wurde bei diesen ersten Versuchen mit Kupfer-Mordenit jedoch dadurch erschwert, dass das anfallende Methanol an der Oberfläche des mit Kupfer durchsetzten Zeoliths stark adsorbiert wurde. Nach der Reaktion von Methan und Sauerstoff brauchte man ein Lösungsmittel, um das Methanol herauszutrennen und in der Folge waren die katalytischen Kupferzentren für weitere Reaktionen nicht mehr verfügbar. Man beobachtete zudem, dass überhaupt nur wenige Kupferatome im Zeolithkristal tatsächlich eine katalytische Wirkung entfalteten.
Forscher des PSI haben an diese Arbeiten angeknüpft und zum ersten Mal einen Prozess entwickelt, bei dem das Methanol ohne den Einsatz von Lösungsmitteln den Reaktor als Endprodukt verlässt. Sie haben das Problem der Methanol-Adsorption in den Griff bekommen und die Anzahl katalytisch aktiver Kupferzentren im Zeolith deutlich erhöht. Ausserdem fanden sie einen Weg, um den Katalyseur regelmässig zu reaktivieren, indem sie Sauerstoff nach jedem Reaktionszyklus in den Reaktor fluteten.. „Wir erreichen auf diese Art und Weise viele Umwandlungszyklen, bevor der Katalysator ausgetauscht werden muss“, sagt die Forscherin Evalyn Mae Alayon, die das Verfahren im Rahmen ihrer Dissertation entwickelte.
Bei der Entwicklung und Verbesserung der neuen Herstellungsmethode haben die PSI-Forschenden von der hervorragenden Grossforschungsinfrastruktur profitiert, die ihnen am PSI zu Gebote steht. So konnten sie durch röntgensprektoskopishe Untersuchungen an der SuperXAS Strahllinie der Synchrotronlichtquelle Schweiz SLS den Erfolg ihres Verfahrens nachweisen, indem sie an den strukturellen Veränderungen der Kupferzentren deren katalytische Aktivität und somit den Fortschritt der Umwandlung von Methan zu Methanol ablasen. In Zukunft wollen sie mithilfe dieser Röntgentechniken das Design des Katalyseurs noch weiter verbessern. Van Bokhoven ist von den Perspektiven in dieser Hinsicht begeistert. Aber schon der bisherige Erfolg erfüllt ihn mit Stolz, galt doch die katalytische Umwandlung von Methan zu Methanol lange unter Chemikern als „golden reaction“ und deren Realisierung als besonders erstrebenswert. Sollte nun eines Tages eine industrielle Realität daraus werden, dann wäre das Ende der globalen Methan-Verschwendung ein Stück weit auch den Mühen der PSI-Wissenschaftler zu verdanken.