Im Dienst der Kranken arbeiten PSI-Wissenschaftler mit radioaktiven Stoffen und entwickeln Arzneimittel, die Strahlung aussenden. Damit helfen sie, Krebsleiden und Entzündungen aufzuspüren und Tumore am Wachstum zu hindern. Ihre Forschung unterstützt Spitäler und ist für die Schweizer Industrie von grossem Interesse.
Der Wettlauf gegen die Zeit startet Montagmorgen im Reinraumlabor des Zentrums für radiopharmazeutische Wissenschaften ZRW am PSI. Ärzte vom Kantonsspital Baden wollen einen Patienten mit Prostatakrebs untersuchen und haben dafür beim PSI ein Radiopharmakon bestellt, ein radioaktives Arzneimittel. Mit seiner Hilfe wollen die Mediziner Tumorzellen im Patienten aufspüren. Das Arzneimittel besteht aus zwei Hauptkomponenten. Ein Teil, der sogenannte Tracer, passt genau zu Zielstrukturen, die auf der Oberfläche von Tumorzellen sitzen, und heftet sich dort an. Die zweite Komponente signalisiert den Ort durch Radioaktivität. Sie besteht nämlich aus einem Radionuklid. So heissen instabile Atome, die bei ihrem Zerfall Strahlung aussenden. Für medizinische Zwecke werden Radionuklide mit einer Halbwertszeit von wenigen Minuten bis eine Woche verwendet. Wegen der Radioaktivität ist ihre Herstellung nur unter bestimmten Sicherheitsvorkehrungen erlaubt, die am PSI gegeben sind. Für die Diagnostik des Prostatakarzinoms stellt das Team im Reinraum-labor das radioaktive Arzneimittel 68Ga-PSMA-11 her. Dafür hat es zwei Tage Vorlauf, doch Mittwoch, am Produktionstag, muss es sich beeilen – in nur 68 Minuten verliert das verwendete Radionuklid die Hälfte seiner Strahlkraft.
- 10:00 Uhr: In einer mit dicken Bleiplatten abgeschirmten sogenannten heissen Zelle startet auf Knopfdruck die Synthese des Wirkstoffs. Langsam tropft eine unscheinbare, klare Flüssigkeit vom Syntheseapparat in ein Gefäss.
- 10:40 Uhr: Die Flüssigkeit mit dem Wirkstoff wird in ein daumengrosses Glasfläschchen abgefüllt und in einen strahlensicheren Behälter gepackt.
- 11:00 Uhr: Das Medikament ist zum Versand per Gefahrguttransport bereit. Der Behälter wird 30 Minuten später im Spital ankommen. Dort wartet bereits der Patient.
- 11:30 Uhr: Das Team am PSI kontrolliert eine zurückbehaltene Probe des Arzneimittels auf seine Qualität und Reinheit und informiert die Klinik über die Freigabe.
- 12:00 Uhr: Das Fachpersonal zieht mit einer Spritze die für den Patienten berechnete Wirkstoffmenge auf und spritzt sie in dessen Venen. Die Untersuchung geht los.
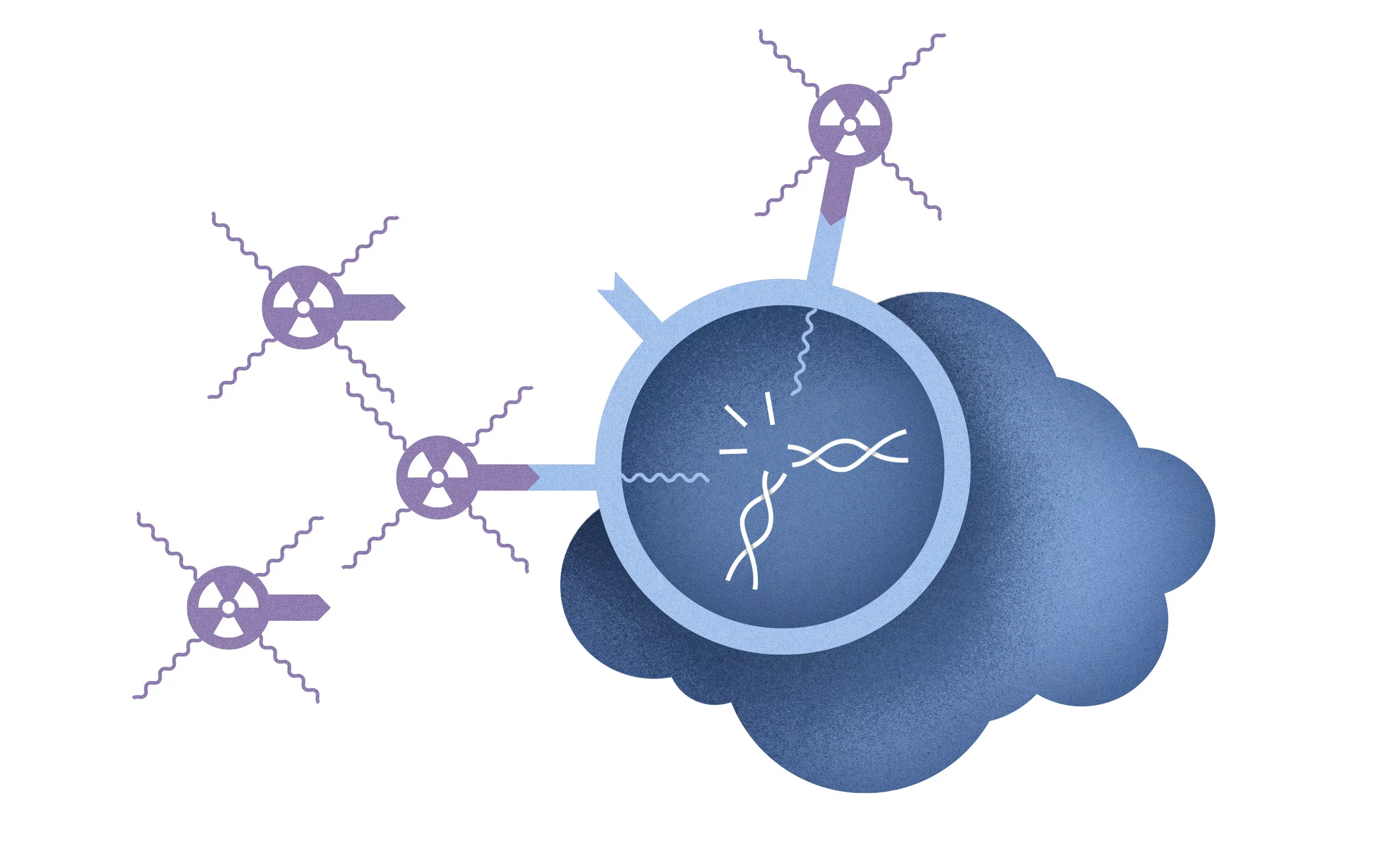
Einmal im Blutkreislauf angekommen, sucht sich das radioaktive Arzneimittel sein Ziel im Körper: die Krebszellen. Diese tragen auf ihrer Oberfläche Strukturen, die charakteristisch für eine Krebsart sind, und die gesunde Zellen nicht aufweisen. An diese Strukturen dockt das Arzneimittel an, das an das Radionuklid gekoppelt ist.
Die radioaktive Strahlung der Arznei macht winzige Ableger des Tumors sichtbar, die man sonst nicht sehen würde. Das gelingt mithilfe von Spezialkameras. Sie erfassen die Strahlung, die der Wirkstoff aus dem Körper des Patienten nach aussen schickt. Daraus errechnet ein Computer Bilder, auf denen Tumorherde farbig erscheinen und gut erkennbar sind. Auch an diesem Tag erfüllt der eingesetzte Wirkstoff seine Aufgabe und die Ärzte am Kantonsspital Baden wissen nun, wo sich der Tumor und seine Ableger im Körper ihres Patienten befinden. Diese Informationen werden genutzt, um eine auf die Situation des Patienten abgestimmte Therapie zu entwickeln.
Aber strahlende Substanzen können weitaus mehr, als Krebszellen aufzuspüren. «Die Eigenschaften eines Radionuklids bestimmen, ob man es zur Diagnostik verwendet oder ob man damit die Krebszellen gezielt zerstört», erklärt Roger Schibli, Leiter des ZRW, einer gemeinsamen Einrichtung des PSI, der ETH Zürich und des Universitätsspitals Zürich. Manche Radionuklide wie Lutetium-177 senden auch zerstörerische Teilchenstrahlung, sogenannte Betastrahlung, aus, die nur wenige Millimeter weit reicht. Sie kann Krebszellen direkt zerstören, sobald das Radiopharmakon an ihnen andockt.
Die besondere Strahlencharakteristik von Lutetium-177 haben sich Chemiker Martin Béhé und seine Arbeitsgruppe am ZRW zunutze gemacht und das Radionuklid mit einem Minigastrin als Tracer gekoppelt. Dieses Molekül bindet sich ganz gezielt an den sogenannten Cholecystokinin-2(CCK2)-Rezeptor, den Tumorzellen des bösartigen medullären Schilddrüsenkarzinoms auf ihrer Oberfläche tragen. Bei dieser Art von Schilddrüsenkrebs ist die sonst etablierte Radio-Jod-Therapie nicht wirksam. Er bildet früh Tochtergeschwülste in anderen Organen und trifft manchmal auch Kinder und junge Erwachsene. «Wenn dieser Tumor Metastasen gebildet hat, war eine Heilung bisher nicht möglich», sagt Béhé. Deshalb suchte er mit seinem Team mehrere Jahre lang nach einem radioaktiven Wirkstoff, um die Tochtergeschwülste zu finden und zu vernichten. Die Forschenden prüften intensiv, welcher Wirkstoff schnell im Körper aufgenommen wird, nur an den CCK2-Rezeptor bindet und andere Gewebe schnell wieder verlässt, um mit seiner Strahlung keine gesunden Zellen zu schädigen. Diese und weitere spezielle Anforderungen erschwerten die Suche nach einer passenden Substanz. Erfolg hatte die Gruppe erst, als sie das Peptid Minigastrin (PSIG-2) mit dem Lutetium-177 kombinierte: Es reicherte sich gezielt an den Zellen des medullären Schilddrüsenkarzinoms an, verblieb nicht in anderen Geweben und wurde rasch aus den Nieren ausgeschieden, um dort keinen Schaden anzurichten. Damit waren die wichtigsten Voraussetzungen erfüllt, um den Wirkstoff im Reinraumlabor des PSI standardisiert nach pharmazeutischen Vorschriften herzustellen – der erste Schritt für den kontrollierten Einsatz am Patienten im Rahmen einer Studie. 2016 war es dann soweit: Mit Erlaubnis der Schweizerischen Zulassungs- und Aufsichtsbehörde für Heilmittel Swissmedic durften Ärzte der Klinik für Radiologie und Nuklearmedizin des Universitäts-spitals Basel den neuen, inzwischen patentierten Wirkstoff erstmals am Menschen einsetzen. «In dieser ersten Studie haben wir den Wirkstoff sechs Patienten gegeben, die ein medulläres Schilddrüsenkarzinom in einem fortgeschrittenen Stadium hatten», berichtet der Basler Nuklearmediziner Christof Rottenburger.
Die Eigenschaften eines Radionuklids bestimmen, ob man es zur Diagnostik verwendet oder ob man damit die Krebszellen gezielt zerstört.
Zu dieser Zeit informierte das PSI auf seiner Webseite über die Entwicklung des Wirkstoffs und dessen Zulassung als Studienmedikament. Dieser Artikel weckte das Interesse der Schweizer Pharmaindustrie. Das Lausanner Unternehmen Debiopharm meldete sich bei Martin Behé am PSI. Die Geschäftsleute liessen sich erklären, woraus der Wirkstoff besteht und wie er im PSI-Labor hergestellt wird, sie stellten Fragen und prüften Unterlagen, und sie schauten sich die Ergebnisse der ersten Patientenstudie ganz genau an. Das Resultat überzeugte: Im Dezember 2017 unterzeichneten Debiopharm und das PSI einen Lizenzvertrag, der es dem Unternehmen erlaubte, den PSI-Wirkstoff für Anwendungen in der Krebsbehandlung weiterzuentwickeln und ihn bis zur Zulassung und damit zur Marktreife zu bringen. Im Juli 2018 war es dann endlich soweit. Der Wirkstoff mit dem Namen 177Lu-PSIG-2 heisst nun auch nach dem Lausanner Pharmaunternehmen: Debio1124.
Am Universitätsspital Basel hat inzwischen der zweite Teil der Patientenstudie mit dem PSI-Wirkstoff begonnen. «Diese Studie ist eine
sogenannte Dosis-Eskalationsstudie», erklärt Rottenburger. «Hier geben wir Patienten mit medullärem Schilddrüsenkarzinom eine als sicher erachtete Wirkstoffdosis und beobachten, ob sie diese Dosis gut und ohne höhergradige Nebenwirkungen an anderen Organen vertragen. Wenn dies der Fall ist, kann die Wirkstoffdosis dann weiter gesteigert werden.» Mit diesem Vorgehen tasten sich die Basler Mediziner gemeinsam mit dem PSI an die Strahlendosis heran, welche Patienten gefahrlos für eine Behandlung erhalten können. Für die Dauer der Studie wird das radioaktive Arzneimittel noch weiterhin im Reinraum am PSI hergestellt – so wie andere Radiopharmaka, die von den Kliniken der Region bestellt werden. Am ZRW tüfteln die Forschenden bereits an den nächsten vielversprechenden Substanzen.
Text: Sabine Goldhahn
Weiterführende Informationen
Und so werden die Radionuklide am PSI hergestellt: Im Fokus der Protonen