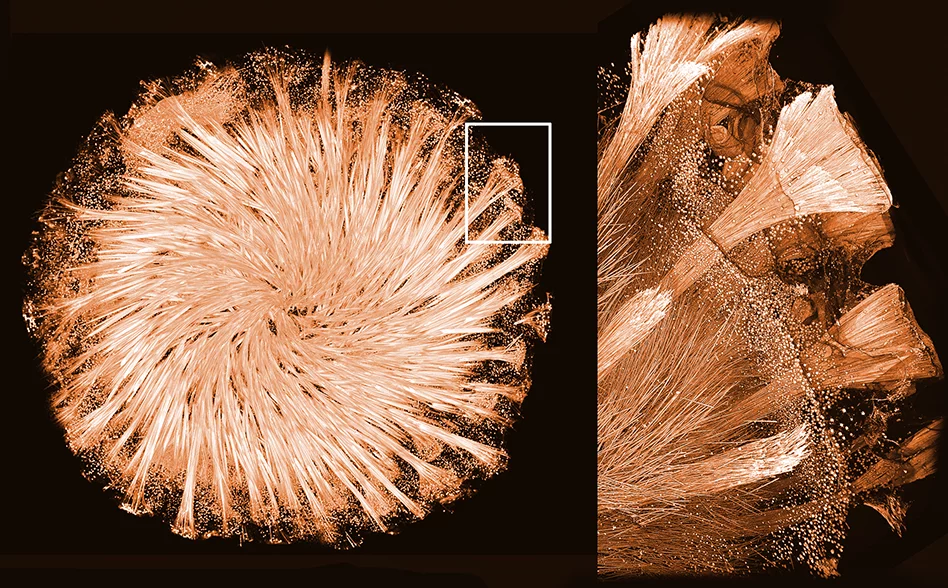
Messungen an der Synchrotron Lichtquelle Schweiz SLS haben dabei geholfen zu verstehen, wie der bisher einzige bekannte natürliche Protein-Mineral-Kristall gebildet wird. Er ist Teil des faszinierenden Glasgerüsts von Schwämmen. Diese Tiere zählen zu den ältesten auf der Erde und leben in vielen verschiedenen Gewässern, von Seen bis zu tiefen Ozeanen. Schon lange fragt sich die Wissenschaft, wie einige Schwammarten aus ungeordnetem Glas ein Netzwerk hochsymmetrischer Skelettelemente formen. Forschende von der TU Dresden haben zusammen mit dem Paul Scherrer Institut PSI und dem Center for Advancing Electronics Dresden erstmals die dreidimensionale Struktur eines Proteins aufgeklärt, das für die Glasbildung in Schwämmen verantwortlich ist. Die Ergebnisse wurden im Journal Proceedings of the National Academy of Sciences of the USA veröffentlicht.
Glasschwämme haben – wie der Name vermuten lässt – ein Skelett auf Glasbasis, das aus einem Netz von Nadeln, Haken, Sternen und Kugeln besteht. Um eine solch einzigartige Architektur zu erreichen, müssen sie die Form von ungeordnetem Glas so manipulieren, dass hochgradig regelmässige und symmetrische Elemente entstehen.
Dünne kristalline Fasern aus einem Protein, dem sogenannten Silikatein, befinden sich in Kanälen im Inneren dieser Glaselemente. Es ist bekannt, dass Silikatein-Kristalle für die Glassynthese in Schwämmen und für die Formgebung des Glasskeletts verantwortlich sind. Bisherige Versuche, die 3-D-Struktur dieses Proteins zu bestimmen, um zu beschreiben, wie es sich zu Kristallen zusammensetzt und wie diese das Glasskelett bilden, waren jedoch nicht erfolgreich – vor allem, weil niemand in der Lage war, diese Kristalle im Labor zu züchten.
Ein Team unter der Leitung von Igor Zlotnikov vom B CUBE - Center for Molecular Bioengineering an der TU Dresden nutzte einen anderen Ansatz: Statt Silikatein im Labor herzustellen, nahmen die Forschenden die Glasnadeln aus einem Schwammskelett und analysierten die winzigen Kristalle, die bereits im Inneren existieren. Das Problem: Da die Kristalle so winzig sind, waren zur Strukturaufklärung ein paar Tricks nötig. Hier konnte das Team von der Synchrotron Lichtquelle Schweiz SLS am PSI helfen.
Viele kleine Kristalle statt ein grosser
Eine traditionelle Methode zur Aufklärung der 3-D-Struktur eines Proteins besteht darin, einen Kristall Röntgenlicht auszusetzen. Die Atome in einem Proteinkristall streuen das Röntgenlicht und liefern so eine einzigartige Momentaufnahme seiner inneren Anordnung. Durch Drehen des Kristalls und Sammeln solcher Momentaufnahmen aus vielen Winkeln erhalten die Forschenden genug Daten, um mit Rechenmethoden die 3-D-Proteinstruktur zu entschlüsseln.
Diese Methode ist weit verbreitet für Kristalle mit einer Grösse von mindestens 10 Mikrometern. Die Zlotnikov-Gruppe wollte jedoch Silikatein-Kristalle analysieren, die etwa 10 Mal kleiner waren. Wenn diese Kristalle Röntgenlicht ausgesetzt waren, wurden sie fast sofort beschädigt, sodass es unmöglich war, einen vollständigen Datensatz aus mehreren Winkeln zu erfassen.
Daher griffen die Forschenden mit Unterstützung des Teams an der SLS zu einer neu aufkommenden Methode, der seriellen Kristallografie: «Man kombiniert dabei die Streuungsbilder von vielen Kristallen», erklärt Filip Leonarski, PSI-Strahllinienwissenschaftler, der an der Studie beteiligt war. «Mit der traditionellen Methode dreht man quasi einen Film; mit der neuen Methode schiesst man viele Schnappschüsse, die man hinterher kombiniert, um die Struktur zu entschlüsseln.» Jeder Schnappschuss wird an einer anderen Stelle dieser kleinen Kristalle gemacht oder sogar an einem anderen Kristall.
Insgesamt sammelten die Forschenden über 3600 Röntgenbeugungsmomentaufnahmen von 90 Glasnadeln in völlig zufälliger Orientierung. Mit modernsten Rechenmethoden konnten sie Ordnung in dem Chaos finden und die Daten zusammensetzen, um die erste vollständige 3-D-Struktur des Silikateins aufzuklären. «Die Datenanalyse war einigermassen aufwendig», sagt Leonarski. «Glücklicherweise haben wir mit der Methode bereits viel Erfahrung, da sie am Freie-Elektronen-Röntgenlaser SwissFEL intensiv genutzt wird.»
Glas-Protein-Superstruktur
Mithilfe der neu gewonnenen 3-D-Struktur des Silikateins konnten die Forscher seinen Aufbau und seine Funktion im Inneren des Glasskeletts des Schwamms verstehen. Zusätzlich setzen die Zlotnikov-Gruppe am Center for Advancing Electronics Dresden (cfaed) die hochauflösende Transmissionselektronenmikroskopie (HRTEM) ein, um die in den Glasnadeln gepackten Silikatein-Kristalle genauer zu untersuchen.
«Wir haben eine außergewöhnlich geordnete und gleichzeitig komplexe Struktur beobachtet», erklärt Zlotnikov. «Bei der Analyse der Probe haben wir festgestellt, dass es sich um eine Mischung aus einem organischen und einem anorganischen Stoff handelt. Das bedeutet, dass sowohl Proteine als auch Glas eine hybride Überstruktur bilden, die irgendwie das Skelett von Schwämmen formt.» Zlotnikov bezeichnet den Aufbau als funktionelle 3-D-Glas-Protein-Superstruktur, die in dieser Art das erste Mal in einem lebenden Organismus detailliert beschrieben wurde.
Text: Erstellt auf der Grundlage einer Medienmitteilung der TU Dresden mit Ergänzungen des Paul Scherrer Instituts/Brigitte Osterath
Link: https://tu-dresden.de/tu-dresden/newsportal/news/ordnung-im-chaos-finde…
Kontakt/Ansprechpartner
Dr. Filip Leonarski
Labor für Makromoleküle und Bioimaging
Paul Scherrer Institut, Forschungsstrasse 111, 5232 Villigen PSI, Schweiz
Telefon: +41 56 310 56 52; E-Mail: filip.leonarski@psi.ch [Englisch, Polnisch]
Dr. Igor Zlotnikov
B CUBE - Center for Molecular Bioengineering
Technische Universität Dresden, Tatzberg 41, 01307 Dresden, Deutschland
Telefon: +49 351 463 43090; E-Mail: igor.zlotnikov@tu-dresden.de
Originalveröffentlichung
Natural hybrid silica/protein superstructure at atomic resolution
S. Görlich, A.J. Samuel, R.J. Best, R. Seidel, J. Vacelet, F.K. Leonarski, T. Tomizaki, B. Rellinghaus, D. Pohl, I. Zlotnikov
Proceedings of the National Academy of Sciences of the USA, 23. November 2020 (online)
DOI: 10.1073/pnas.2019140117
Nutzungsrechte
Das PSI stellt Bild- und/oder Videomaterial für eine Berichterstattung über den Inhalt des obigen Textes in den Medien kostenfrei zur Verfügung. Eine Verwendung dieses Materials für andere Zwecke ist nicht gestattet. Dazu gehören auch die Übernahme des Bild- und Videomaterials in Datenbanken sowie ein Verkauf durch Dritte.